Hvorfor opløses salt i varmt vand?
1. Øget kinetisk energi:
* molekyler bevæger sig hurtigere: Varme giver energi til vandmolekyler, hvilket får dem til at bevæge sig hurtigere og vibrere mere intenst. Denne øgede kinetiske energi giver dem mulighed for at bryde de ioniske bindinger fra hinanden med natrium (Na+) og chlorid (Cl-) ioner sammen i saltkrystallen.
* Flere kollisioner: Den hurtigere bevægelse af vandmolekyler resulterer i hyppigere kollisioner med saltkrystallen, hvilket øger chancerne for at forstyrre de ioniske bindinger og frigive ioner i opløsning.
2. Øget polaritet:
* svækkede brintbindinger: Når vand opvarmes, bliver hydrogenbindingerne mellem vandmolekyler svagere, hvilket giver dem mulighed for lettere at interagere med de ladede ioner.
* Forbedret solvation: Denne svækkelse af hydrogenbindinger forbedrer vandmolekylernes evne til at omringe og isolere de individuelle Na+ og Cl- ioner, hvilket forhindrer dem i at omdanne til saltkrystallen.
3. Øget opløselighed:
* Højere opløselighed: Opløseligheden af salt i vand øges med temperaturen. Dette betyder, at vandet ved højere temperaturer kan indeholde mere opløst salt, før de når mætning.
Kortfattet: Varmt vand giver mere energi til at forstyrre de ioniske bindinger i saltkrystaller, hvilket fører til hurtigere opløsning og større opløselighed. Den øgede kinetiske energi af vandmolekyler sammen med de svækkede brintbindinger forbedrer vandets evne til at solvere ionerne og holde dem i opløsning.
 Varme artikler
Varme artikler
-
 Tager Australiens hjemmedyrkede superfood mainstreamEt lupinfrø. Kredit:Edith Cowan University Lupiner har længe været udråbt som den næste superfood, bekæmpelse af hjertesygdomme, diabetes og fedme og ny forskning fra Edith Cowan University (ECU)
Tager Australiens hjemmedyrkede superfood mainstreamEt lupinfrø. Kredit:Edith Cowan University Lupiner har længe været udråbt som den næste superfood, bekæmpelse af hjertesygdomme, diabetes og fedme og ny forskning fra Edith Cowan University (ECU) -
 Kemikere udnytter lysets kraft til at tackle asymmetriske molekylerFSU-forskere brugte lys til at forvandle et venstrehåndsmolekyle til et højrehåndet. Kredit:Adjunkt i kemi Ken Hanson Ingen, molekyler har faktisk ikke hænder. Men videnskabsmænd omtaler dem på de
Kemikere udnytter lysets kraft til at tackle asymmetriske molekylerFSU-forskere brugte lys til at forvandle et venstrehåndsmolekyle til et højrehåndet. Kredit:Adjunkt i kemi Ken Hanson Ingen, molekyler har faktisk ikke hænder. Men videnskabsmænd omtaler dem på de -
 Opdagelse af, hvordan amyloider binder metalioner kaster lys over proteinets funktion”Selvom der har været en masse højopløsninger, atomært strukturarbejde på amyloider ved faststof-NMR, mennesker har virkelig ikke undersøgt de metalbindende aspekter, ”Siger professor Mei Hong. Kredit
Opdagelse af, hvordan amyloider binder metalioner kaster lys over proteinets funktion”Selvom der har været en masse højopløsninger, atomært strukturarbejde på amyloider ved faststof-NMR, mennesker har virkelig ikke undersøgt de metalbindende aspekter, ”Siger professor Mei Hong. Kredit -
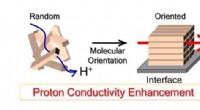 Få mere kontrol over brændselscellemembranerMolekylær orientering forbedrer protonkonduktion i protonkonduktive polymerer. Kredit:Yuki Nagao Mere organisering på molekylært niveau kan forbedre effektiviteten af membraner, der bruges i bri
Få mere kontrol over brændselscellemembranerMolekylær orientering forbedrer protonkonduktion i protonkonduktive polymerer. Kredit:Yuki Nagao Mere organisering på molekylært niveau kan forbedre effektiviteten af membraner, der bruges i bri


