Opdagelse af, hvordan amyloider binder metalioner kaster lys over proteinets funktion
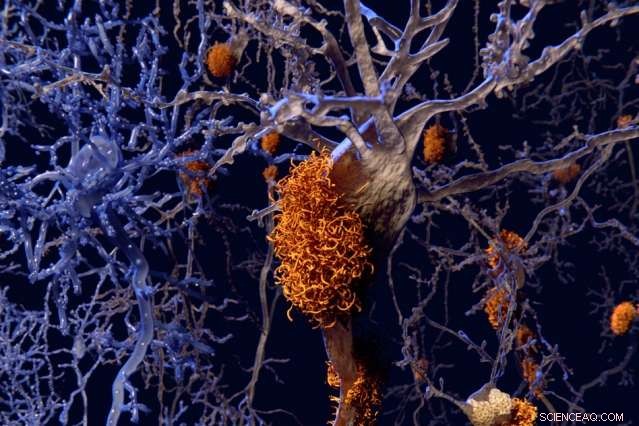
”Selvom der har været en masse højopløsninger, atomært strukturarbejde på amyloider ved faststof-NMR, mennesker har virkelig ikke undersøgt de metalbindende aspekter, ”Siger professor Mei Hong. Kredit:Massachusetts Institute of Technology
Amyloider er klumper af proteinfragmenter, der klæber sammen for at danne trådede fibriller, f.eks. Plaketterne, der ses i hjernen hos Alzheimers patienter. Mange af disse proteiner binder sig til metaller såsom zink, men strukturen af disse metalbundne proteiner har været vanskelig at studere. Betydningen af disse metaller for amyloids aktivitet er således fortsat et åbent spørgsmål, hvilket er desto mere forvirrende, fordi nogle amyloider er forbundet med sygdom, men andre ikke.
Et team af MIT -kemikere, arbejder med forskere ved University of California i San Francisco (UCSF) og Syracuse University, har nu dechiffreret strukturen af et amyloid, der binder sig til zink. Deres tilgang, baseret på nuklear magnetisk resonans (NMR), kunne også bruges til at afsløre strukturer af yderligere metalbundne amyloider.
"Selvom der har været en masse højopløsninger, atomært strukturarbejde på amyloider ved faststof-NMR, mennesker har virkelig ikke undersøgt de metalbindende aspekter, "siger Mei Hong, en MIT -professor i kemi og en af de højtstående forfattere af papiret, som vises i Procedurer fra National Academy of Sciences ugen den 29. maj.
Forskere ved UCSF og Syracuse designede amyloidproteinet til at katalysere en specifik reaktion:at kombinere kuldioxid og vand til dannelse af bikarbonat. Den nyopdagede struktur af amyloidet kaster lys over, hvordan proteinet udfører denne funktion, og hvordan zink hjælper i reaktionskatalysen.
William DeGrado, professor i farmaceutisk kemi ved UCSF, er avisens anden seniorforfatter. MT -kandidatstuderende Myungwoon Lee er hovedforfatter af papiret.
Strukturbestemmelse
Mens amyloider ofte er forbundet med sygdomme som Alzheimers og Parkinsons sygdomme, andre amyloider har normale biologiske funktioner.
UCSF- og Syracuse-forskerne rapporterede først deres kunstige amyloid i 2014. Deres mål var at producere et meget enkelt metalbundet protein, der kunne katalysere en kemisk reaktion, der er nødvendig for livet, i håb om at demonstrere, at sådanne simple metalbundne peptider kunne have været forstadier til nutidens enzymer. I det papir, de viste, at peptidet, som består af syv aminosyrer bundet til en zinkion, kunne katalysere omdannelsen af kuldioxid og vand til bicarbonat lige så effektivt som enzymet carbonanhydrase, som udfører denne reaktion i levende celler og også kræver zink.
"Det er sandsynligt for meget små peptider, der bærer metalioner, at lave kemi, og udviklingen af enzymaktiviteter kan have startet fra disse små peptider, "Siger Hong.
UCSF -forskerne designede deres peptid, så dets aktive sted, hvor den kemiske reaktion finder sted, vil efterligne kulsyreanhydrase, som har en zinkion bundet til tre kæder af aminosyren histidin. Imidlertid, de kendte ikke den præcise struktur af fibrillerne dannet af deres peptid, det er her, Hong og hendes MIT -kolleger kom ind.
For at bestemme strukturen, forskergruppen brugte en todelt tilgang baseret på NMR-spektroskopi og bioinformatik, som er en metode til at bruge computeralgoritmer til at analysere biologiske data.
Ved hjælp af NMR, forskerne fastslog først, at peptiderne danner en lang fibril kæde, der består af lag af strukturer kaldet beta -ark. Inden for hvert beta -ark, hver peptidstreng har to histidiner, der kan interagere med den næste streng. Deres næste mål var at bestemme, hvordan zinkionerne passer ind i denne multistandede og flerlagsstruktur.
NMR bruger atomkernenes magnetiske egenskaber til at afsløre strukturer i molekylerne, der indeholder disse kerner. I dette tilfælde, forskerne brugte NMR til at analysere signaler fra centrale nitrogenatomer i histidinsidekæderne, der interagerer med zinkioner. Ved at sammenligne disse signaler, når amyloiderne var og ikke var bundet til zink, forskerne fastslog, at halvdelen af histidinerne koordinerer et zinkatom hver, mens den anden halvdel interagerer med to zinkatomer hver. "Den høje koncentration af histidiner, der bygger bro mellem to zinkioner, er meget usædvanlig, "Siger Hong.
Forskerne brugte også NMR til at måle vinklerne på bindingerne, der tillader histidin at interagere med zink, og derefter brugt bioinformatik til at bestemme de mulige strukturer i overensstemmelse med disse konfigurationer. Dette afslørede, at et zinkatom sidder mellem to amyloid-beta-tråde, og den er bundet til et histidin sidekæde ovenfra og to nedenunder. Dette danner en tetraedrisk struktur, hvor tre histidinnitrogener holder zinket på plads, mens et histidinnitrogen forbliver uforbundet.
Tidlig katalyse
Det løsrevne histidin -nitrogen er frit for at binde til et molekyle vand, som er nødvendig for at udføre reaktionen katalyseret af zinkionen. Hongs samarbejdspartnere ved UCSF har tidligere vist, at dette amyloid katalyserer bikarbonatdannelse med en hastighed, der svarer til kulsyreanhydrase, understøtter teorien om, at denne type simpel amyloid kunne have været brugt af tidlige livsformer til at udføre vigtige reaktioner.
Hong planlægger nu at begynde at studere strukturen af metalbundne amyloider involveret i neurodegenerative sygdomme. De amyloider, der er involveret i både Parkinsons og Alzheimers sygdomme, har vist sig at binde sig til metalioner, herunder zink og kobber, men hvordan disse metaller påvirker sygdommene vides ikke, ej heller er deres strukturer blevet bestemt.
"Der har været nogle molekylære dynamiksimuleringer for at gætte, hvordan metaller binder disse histidiner, men der har ikke været nogen høj opløsning, atomundersøgelse af koordineringsstrukturen, "Siger Hong.
Denne historie er genudgivet med tilladelse fra MIT News (web.mit.edu/newsoffice/), et populært websted, der dækker nyheder om MIT -forskning, innovation og undervisning.
Sidste artikelLab skaber hårde, men øm, kræftkæmpere
Næste artikelModel til 2-D materialebaseret RRAM fundet
 Varme artikler
Varme artikler
-
 100 procent biobaseret, gennemsigtig, og termisk stabil polyamidFra træaffald til højtydende polymerer:Terpener fra terpentin omdannes til biobaserede, gennemsigtige og varmestabile polyamider under påføring af en ny katalytisk proces. Kredit:Fraunhofer IGB De
100 procent biobaseret, gennemsigtig, og termisk stabil polyamidFra træaffald til højtydende polymerer:Terpener fra terpentin omdannes til biobaserede, gennemsigtige og varmestabile polyamider under påføring af en ny katalytisk proces. Kredit:Fraunhofer IGB De -
 Polarisering af brommolekyle i vanadiumoxidklyngehulrum og ny alkanbromeringSpektrets top på grund af polariseret brommolekyle. Kredit:Kanazawa University Alkaner er hovedbestanddelene i naturgas og olie, kun bestående af kulstof- og brintatomer. CH-bindingerne af alkaner
Polarisering af brommolekyle i vanadiumoxidklyngehulrum og ny alkanbromeringSpektrets top på grund af polariseret brommolekyle. Kredit:Kanazawa University Alkaner er hovedbestanddelene i naturgas og olie, kun bestående af kulstof- og brintatomer. CH-bindingerne af alkaner -
 Forskere tilbyder perspektiver på kavitationsvidenskabChristopher Barney, venstre, og prof. Al Crosby, udføre et kavitationseksperiment i Crosbys materialevidenskabelige laboratorium på UMass Amherst Kredit:UMass Amherst En type skade i bløde materia
Forskere tilbyder perspektiver på kavitationsvidenskabChristopher Barney, venstre, og prof. Al Crosby, udføre et kavitationseksperiment i Crosbys materialevidenskabelige laboratorium på UMass Amherst Kredit:UMass Amherst En type skade i bløde materia -
 Hvad er formålet med en pipette?Selvom de ikke er så berømte som bægerglas, koniske kolber og petriskåle, der ofte er forbundet med laboratorier og videnskabelig forskning, er der kun få laboratorieværktøjer, der er lige så vig
Hvad er formålet med en pipette?Selvom de ikke er så berømte som bægerglas, koniske kolber og petriskåle, der ofte er forbundet med laboratorier og videnskabelig forskning, er der kun få laboratorieværktøjer, der er lige så vig
- Ingeniører udvikler nyt magnetisk blæk til at printe selvhelbredende enheder, der heler på rekord…
- Dyb læring hjælper med at drille geninteraktioner ud
- FORKLARER:Den virkelige matematik bag netto nul CO2-emissioner
- Revolutionerende tilgang til lagring og brug af kulstof, og den imponerende indsats, det vil tage at…
- Zuckerberg afslører planer for Facebook-datingtjeneste
- Sådan konverteres gram til ounces & pounds


