Hvilke initierer kemiske reaktioner ved at bryde bindinger i reaktanterne?
Her er hvorfor:
* obligationer er stabile: Kemiske bindinger holder atomer sammen i molekyler. For at bryde disse obligationer kræves energi.
* aktiveringsenergi er "kickstart": Aktiveringsenergi er den mindste mængde energi, som reaktantmolekyler skal have for at overvinde energibarrieren og indlede en reaktion.
* Kollision og energioverførsel: Når molekyler kolliderer med tilstrækkelig energi, kan de overvinde aktiveringsenergibarrieren. Denne energi bruges til at strække og svække eksisterende obligationer, hvilket gør dem modtagelige for brud.
Tænk på det sådan: Forestil dig en bold øverst på en bakke. Det har potentiel energi, men ruller ikke ned, medmindre det gives et skub (aktiveringsenergi). Når den er skubbet, ruller bolden ned ad bakken (reaktionen fortsætter).
hvordan aktiveringsenergi leveres:
* varme: Opvarmning af reaktanterne giver mere kinetisk energi til molekylerne, hvilket øger sandsynligheden for vellykkede kollisioner med nok energi til at bryde bindinger.
* lys: Nogle reaktioner initieres af lys, som kan give den energi, der er nødvendig for at bryde bindinger.
* katalysatorer: Katalysatorer sænker aktiveringsenergien i en reaktion, hvilket gør det lettere at starte. De gør dette ved at tilvejebringe en alternativ vej til reaktionen med en lavere energibarriere.
Sammenfattende er aktiveringsenergi den nøglefaktor, der udløser kemiske reaktioner ved at tilvejebringe den energi, der er nødvendig for at bryde bindinger i reaktanterne.
Sidste artikelNavnet for de fleste ioniske forbindelser bortset fra oxider?
Næste artikelHvad er forholdet mellem atomer af siliciumdioxid?
 Varme artikler
Varme artikler
-
 Formskiftende middel er rettet mod skadelige bakterier i mavenKredit:University of Illinois i Urbana-Champaign En ny formskiftende polymer kan målrette og dræbe Helicobacter pylori-bakterier i maven uden at dræbe nyttige bakterier i tarmen. En sådan behandli
Formskiftende middel er rettet mod skadelige bakterier i mavenKredit:University of Illinois i Urbana-Champaign En ny formskiftende polymer kan målrette og dræbe Helicobacter pylori-bakterier i maven uden at dræbe nyttige bakterier i tarmen. En sådan behandli -
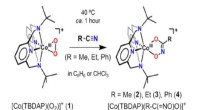 Nyt kompleks, der reagerer med nitril - en nøgle til at muliggøre nedregulering af kræftenzymerSyntetisk procedure for hydroximatocobaltkomplekser gennem reaktioner af et peroxocobaltkompleks 1 med nitriler. Kredit:DGIST Der er forskellige metalenzymer i menneskekroppen. Metalenzymer intera
Nyt kompleks, der reagerer med nitril - en nøgle til at muliggøre nedregulering af kræftenzymerSyntetisk procedure for hydroximatocobaltkomplekser gennem reaktioner af et peroxocobaltkompleks 1 med nitriler. Kredit:DGIST Der er forskellige metalenzymer i menneskekroppen. Metalenzymer intera -
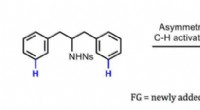 Kemikere opnår en vigtig milepæl for syntese:Fjern chiral induktionDen nye metode udviklet af Yu og kolleger. Kredit:Jin-Quan Yu/Scripps Research Kemikere ved Scripps Research har adresseret en af de mest formidable udfordringer inden for syntetisk kemi ved at
Kemikere opnår en vigtig milepæl for syntese:Fjern chiral induktionDen nye metode udviklet af Yu og kolleger. Kredit:Jin-Quan Yu/Scripps Research Kemikere ved Scripps Research har adresseret en af de mest formidable udfordringer inden for syntetisk kemi ved at -
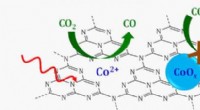 Lysaktiveret, single-ion katalysator nedbryder kuldioxidSkematisk over en enkeltstedskatalysator, hvor enkelte koboltioner (CO 2 +) understøttet på et grafitisk kulstofnitrogenlag (C3N4) reducerer kuldioxid (CO 2 ) til carbonmonoxid (CO) i nærvær af sy
Lysaktiveret, single-ion katalysator nedbryder kuldioxidSkematisk over en enkeltstedskatalysator, hvor enkelte koboltioner (CO 2 +) understøttet på et grafitisk kulstofnitrogenlag (C3N4) reducerer kuldioxid (CO 2 ) til carbonmonoxid (CO) i nærvær af sy
- Hvor stor er Epsilon Orionis?
- Hvilken type dinoflagellat har røde fotosyntetiske pigmenter?
- Hvad er kraftværket i cellen, hvor energi produceres?
- Ser plantefotosyntese ... fra rummet
- Forklar, hvordan kemikere kan med sikkerhed sige, at ingen vil opdage et element mellem svovl og klo…
- Patentsnak:Apple -konceptet har ørepropper, der kan bæres i flæng


