Hvorfor er en nitration stærkere base end sulfidion?
* Grundlighed: Grundlighed henviser til en arts evne til at acceptere en proton (H⁺). Stærkere baser er mere tilbøjelige til at acceptere protoner.
* Faktorer, der påvirker grundlæggende: Flere faktorer bidrager til basis af en ion:
* Elektronegativitet: Flere elektronegative atomer holder elektroner mere tæt, hvilket gør dem mindre tilbøjelige til at donere dem og derfor mindre grundlæggende. Oxygen er mere elektronegativ end svovl.
* størrelse: Større atomer har deres valenselektroner længere fra kernen, hvilket gør dem mere tilbøjelige til at blive doneret og dermed mere basale. Svovl er større end ilt.
* opladning: Mere negativ ladning øger evnen til at tiltrække protoner, hvilket gør arten mere basale. Både sulfid og nitrat har en -2 -ladning.
* Anvendelse af disse faktorer:
* sulfidion (s²⁻): Den større størrelse af svovl og -2 -ladningen gør det til en stærkere base.
* nitration (ingen₃⁻): Elektronegativiteten af ilt gør det mindre sandsynligt, at det donerer elektroner og derfor mindre grundlæggende. Derudover reducerer delokaliseringen af elektroner inden i nitrationen yderligere dens grundlæggende.
Sammenfattende er sulfidion en stærkere base end nitration på grund af den større størrelse og mindre elektronegative natur af svovl sammenlignet med ilt.
 Varme artikler
Varme artikler
-
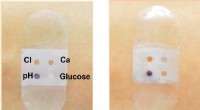 Biosensorbandage opsamler og analyserer svedBiosensorbandage før (venstre) og efter (højre) svedsekretion. Kredit:American Chemical Society Ligesom andre biovæsker, sved indeholder et væld af informationer om, hvad der foregår inde i kroppe
Biosensorbandage opsamler og analyserer svedBiosensorbandage før (venstre) og efter (højre) svedsekretion. Kredit:American Chemical Society Ligesom andre biovæsker, sved indeholder et væld af informationer om, hvad der foregår inde i kroppe -
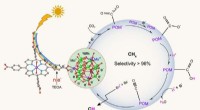 Polyoxometalat-baserede koordinationsrammer for metangenerering i fotoreduktion af kuldioxidPOMCF til konvertering af CO2 til CH4 i fotoreduktionssystem Kredit:©Science China Press Overdreven CO 2 udledning fra vedvarende afbrænding af fossile brændstoffer har forårsaget global opvarmn
Polyoxometalat-baserede koordinationsrammer for metangenerering i fotoreduktion af kuldioxidPOMCF til konvertering af CO2 til CH4 i fotoreduktionssystem Kredit:©Science China Press Overdreven CO 2 udledning fra vedvarende afbrænding af fossile brændstoffer har forårsaget global opvarmn -
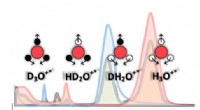 Flydende vand er mere end bare brint-ilt-molekylerInfrarøde lysspektre (rødt), tung (blå), halvtungt (grå) vand, og ioniske arter, der er blevet identificeret i den aktuelle undersøgelse. Rød, hvide og sorte cirkler viser ilt, hydrogen- og deuteriuma
Flydende vand er mere end bare brint-ilt-molekylerInfrarøde lysspektre (rødt), tung (blå), halvtungt (grå) vand, og ioniske arter, der er blevet identificeret i den aktuelle undersøgelse. Rød, hvide og sorte cirkler viser ilt, hydrogen- og deuteriuma -
 Opdagelse kan fjerne mikropollutanter fra miljøetDr. Rong Ye (til venstre), Dr. Ming Zhao (i midten), og Dr. Peng Cheng (til højre) i Cornell diskuterer deres hærfinansierede forskning, der identificerer en ny kemitilgang, der kan fjerne mikropollut
Opdagelse kan fjerne mikropollutanter fra miljøetDr. Rong Ye (til venstre), Dr. Ming Zhao (i midten), og Dr. Peng Cheng (til højre) i Cornell diskuterer deres hærfinansierede forskning, der identificerer en ny kemitilgang, der kan fjerne mikropollut
- Er du enig i udsagnet Et objekt, som en nulhastighed kan have acceleration, der er større end enig?…
- August 2017:Historietips fra Institut for Energys Oak Ridge National Laboratory
- Hvad hedder det, når der er en flok stjerner?
- Hvilket rumfartøj var involveret i rumløbet?
- Begrænsning af global opvarmning ved CO2 -lagring? Kontroller kontinentalt stress
- Kunne brintbiler tage over som den foretrukne 'grønne' bil?


