Hvorfor har aluminium et højere smeltepunkt end natrium?
1. Metallisk binding: Både aluminium og natrium udviser metallisk binding, hvor elektroner delokaliseres og deles i hele metalgitteret. Imidlertid adskiller styrken af denne binding sig markant.
2. Antal valenselektroner: Aluminium har tre valenselektroner, mens natrium kun har en. Dette betyder, at aluminium har flere elektroner til rådighed til delokalisering, hvilket bidrager til stærkere metallisk binding.
3. Atomstørrelse: Aluminiumatomer er mindre end natriumatomer. Denne nærmere nærhed mellem de positivt ladede kerner og de delokaliserede elektroner resulterer i stærkere elektrostatiske attraktioner, hvilket yderligere styrker den metalliske binding.
4. Krystalstruktur: Aluminium har en ansigtscentreret kubisk (FCC) krystalstruktur, som er tættere pakket end den kropscentrerede kubiske (BCC) struktur af natrium. Denne tættere pakning forbedrer styrken af de metalliske bindinger.
Kortfattet:
* stærkere metallisk binding: Aluminiums stærkere metalliske binding på grund af et større antal valenselektroner, mindre atomstørrelse og en mere pakket krystalstruktur fører til et højere smeltepunkt.
* svagere metallisk binding: Natriums svagere metalliske binding på grund af et færre antal valenselektroner, større atomstørrelse og en mindre tæt pakket struktur resulterer i et lavere smeltepunkt.
Derfor forklarer kombinationen af disse faktorer, hvorfor aluminium har et signifikant højere smeltepunkt end natrium.
 Varme artikler
Varme artikler
-
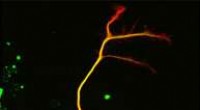 Et afgørende enzym blev endelig afsløretKredit:CEA Efter 40 års forskning, forskere ved CEA, CNRS, Universitetet i Grenoble-Alperne, Universitetet i Montpellier og Inserm har endelig identificeret det enzym, der er ansvarligt for tubuli
Et afgørende enzym blev endelig afsløretKredit:CEA Efter 40 års forskning, forskere ved CEA, CNRS, Universitetet i Grenoble-Alperne, Universitetet i Montpellier og Inserm har endelig identificeret det enzym, der er ansvarligt for tubuli -
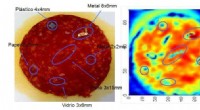 Design af sensorer til at detektere fremmedlegemer i fødevarerBillede opnået med denne teknologi, hvor der kan ses, på et stykke pølse, plast, metaller og splinter af glas i forskellige størrelser og former. Kredit:Elhuyar Fundazioa Forskere ved NUP/UPNA-Pub
Design af sensorer til at detektere fremmedlegemer i fødevarerBillede opnået med denne teknologi, hvor der kan ses, på et stykke pølse, plast, metaller og splinter af glas i forskellige størrelser og former. Kredit:Elhuyar Fundazioa Forskere ved NUP/UPNA-Pub -
 Forskere hjælper med at udvikle bæredygtige polymererUndersøgelsen af Rufina Alamo og den tidligere doktorand Xiaoshi Zhang blev vist på forsiden af Macromolecules. Alamo og Zhang designede illustrationen, og Zhang tegnede det. Kredit:Xiaoshi Zhang
Forskere hjælper med at udvikle bæredygtige polymererUndersøgelsen af Rufina Alamo og den tidligere doktorand Xiaoshi Zhang blev vist på forsiden af Macromolecules. Alamo og Zhang designede illustrationen, og Zhang tegnede det. Kredit:Xiaoshi Zhang -
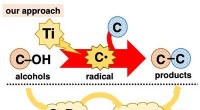 Alkoholer som kulstofradikale forstadierDirekte brug af alkoholer til C-C bindingsdannelsesreaktioner. Kredit:Kanazawa University Alkoholer spiller en afgørende rolle i organisk syntese, fordi de er allestedsnærværende og kan bruges i e
Alkoholer som kulstofradikale forstadierDirekte brug af alkoholer til C-C bindingsdannelsesreaktioner. Kredit:Kanazawa University Alkoholer spiller en afgørende rolle i organisk syntese, fordi de er allestedsnærværende og kan bruges i e


