Hvad kan svovl lide at binde til?
mest almindelige bindingspartnere:
* ilt (O): Svovl danner let stærke bindinger med ilt, hvilket fører til dannelse af sulfater (SO₄²⁻), sulfitter (SO₃²⁻) og svovloxider (SO₂ og SO₃). Disse forbindelser er afgørende i forskellige industrielle processer, dannelse af surt regn og endda biologiske processer som respiration.
* brint (H): Svovl danner hydrogensulfid (H₂S), en grimrende gas, der er ansvarlig for det "rådne æg" lugt. Det deltager også i dannelsen af thioler (R-SH), organiske forbindelser med svovl-hydrogenbindinger, der spiller vigtige roller i forskellige biologiske processer.
* carbon (c): Svovl danner en lang række organiske forbindelser med kulstof, inklusive thioler, sulfider (R-S-R), disulfider (R-S-S-R) og sulfonsyrer (R-SO₃H). Disse forbindelser findes i forskellige naturlige produkter, farmaceutiske stoffer og industrielle materialer.
Andre bindingspartnere:
* Metaller: Svovlbindinger let med metaller til dannelse af sulfider. Disse forbindelser findes ofte i mineraler, såsom jernpyrit (fes₂). Mange metalsulfider er vigtige kilder til metaller.
* halogener: Svovl kan danne bindinger med halogener som chlor (CL) og fluor (F), hvilket producerer forbindelser som sulfurylchlorid (SO₂CL₂) og svovl hexafluorid (SF₆).
Faktorer, der påvirker binding:
* Elektronegativitet: Svovls moderate elektronegativitet giver den mulighed for at danne både ioniske og kovalente bindinger.
* Valenselektroner: Svovl har seks valenselektroner, der gør det muligt for det at danne op til to dobbeltbindinger eller flere enkeltbindinger.
* Oxidation siger: Svovl kan udvise forskellige oxidationstilstande fra -2 til +6, hvilket påvirker dens bindingsadfærd.
Vigtige overvejelser:
* stabilitet: Svovls bindingspræferencer er stærkt påvirket af opnåelse af stabilitet. Det foretrækker at danne bindinger, der resulterer i en fuld oktet af elektroner i dens ydre skal.
* reaktivitet: Svovl kan være meget reaktiv, især i nærvær af ilt eller varme. Denne reaktivitet udnyttes i forskellige industrielle processer.
Sulfurs forskellige bindingsadfærd gør det til et vigtigt element i en lang række anvendelser, fra energiproduktion og fremstilling til biologiske processer og medicin.
Sidste artikelHvad bruges svovlnitrat til?
Næste artikelHvad er pH af zinkoxid?
 Varme artikler
Varme artikler
-
 Ekstremt stærke og alligevel utrolig duktile flerkomponentlegeringer udvikletDen nye legering Al 7 Ti 7 udviser en overlegen styrke på 1,5 gigapascal og duktilitet så høj som 50 procent i spænding ved omgivelsestemperatur. Kredit:City University of Hong Kong Et forsker
Ekstremt stærke og alligevel utrolig duktile flerkomponentlegeringer udvikletDen nye legering Al 7 Ti 7 udviser en overlegen styrke på 1,5 gigapascal og duktilitet så høj som 50 procent i spænding ved omgivelsestemperatur. Kredit:City University of Hong Kong Et forsker -
 Forskere er tæt på kræftbehandlinger ved hjælp af CRISPRKredit:CC0 Public Domain Kemoterapi arbejder ud fra en grundlæggende forudsætning:dræb alle hurtigt voksende celler i et forsøg på at udslette tumorceller. Taktikken, selvom det generelt er effekt
Forskere er tæt på kræftbehandlinger ved hjælp af CRISPRKredit:CC0 Public Domain Kemoterapi arbejder ud fra en grundlæggende forudsætning:dræb alle hurtigt voksende celler i et forsøg på at udslette tumorceller. Taktikken, selvom det generelt er effekt -
 Undersøgelse bekræfter høj strålingsmodstand af højentropi-karbidkeramikKredit:Journal of the European Ceramic Society (2022). DOI:10.1016/j.jeurceramsoc.2022.01.061 En ny undersøgelse om bestrålingsevaluering af højentropi carbid keramik (HECCer) har påvist deres bemæ
Undersøgelse bekræfter høj strålingsmodstand af højentropi-karbidkeramikKredit:Journal of the European Ceramic Society (2022). DOI:10.1016/j.jeurceramsoc.2022.01.061 En ny undersøgelse om bestrålingsevaluering af højentropi carbid keramik (HECCer) har påvist deres bemæ -
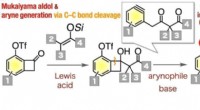 En dejlig reaktiv ring til det:Nye syntetiske veje til forskellige aromatiske forbindelserMukaiyama aldol-reaktionen af 6-(triflyloxy)benzocyclobutenoner med ketensilylacetaler og efterfølgende generering af aryner af γ-aryl-β-ketoester-type fra resulterende 6-(triflyloxy)benzocyclobuten
En dejlig reaktiv ring til det:Nye syntetiske veje til forskellige aromatiske forbindelserMukaiyama aldol-reaktionen af 6-(triflyloxy)benzocyclobutenoner med ketensilylacetaler og efterfølgende generering af aryner af γ-aryl-β-ketoester-type fra resulterende 6-(triflyloxy)benzocyclobuten
- Proxima Centauris ikke godt, meget dårlig dag
- Forsker arbejder på at forstå, hvordan gonoré udvikler resistens antibiotika
- En treløs slette, der er placeret i Arktis eller Antarktis og kendetegnet ved meget lave vintertemp…
- Hvad er klassificeringen af en Euglena gracilis i Kingdom Protista?
- Hvad kan der ske med et opvarmet bægerglas lavet af glas, der ikke indeholder bor, hvis de blev anb…
- Hvordan mikroskopiske maskiner kan mislykkes på et øjeblik


