Hvis du blev bedt om at oprette en saltforbindelse, hvad reaktanter ville vælge, og produkterne reaktionsudbyttet?
Her er en generel reaktion:
syre + base → salt + vand
Lad os nedbryde de forskellige valg, du har:
syrer:
* Stærke syrer: Disse ioniserer ioniserer i vand, hvilket giver en høj koncentration af H+ -ioner. Eksempler inkluderer:
* Saltsyre (HCL)
* Svovlsyre (H₂so₄)
* Salpetersyre (hno₃)
* svage syrer: Disse ioniserer delvist i vand og giver en lavere koncentration af H+ -ioner. Eksempler inkluderer:
* Eddikesyre (ch₃cooh)
* Kulsyre (h₂co₃)
* Fosforsyre (H₃po₄)
baser:
* Stærke baser: Disse dissocierer fuldt ud i vand, hvilket giver en høj koncentration af OH-ioner. Eksempler inkluderer:
* Natriumhydroxid (NaOH)
* Kaliumhydroxid (KOH)
* Calciumhydroxid (CA (OH) ₂)
* svage baser: Disse dissocieres delvist i vand, hvilket giver en lavere koncentration af OH-ioner. Eksempler inkluderer:
* Ammoniak (NH₃)
* Magnesiumhydroxid (mg (OH) ₂)
Eksempler på reaktioner:
* HCL (syre) + NaOH (base) → NaCl (salt) + H₂O (vand)
* Denne reaktion danner bordsalt (natriumchlorid).
* h₂so₄ (syre) + Ca (OH) ₂ (base) → Caso₄ (salt) + 2H₂O (vand)
* Denne reaktion danner calciumsulfat, en almindelig komponent af gips og gips.
* ch₃cooh (syre) + nh₃ (base) → ch₃coonh₄ (salt) + h₂o (vand)
* Denne reaktion danner ammoniumacetat, et almindeligt salt, der anvendes i pufferopløsninger.
nøglepunkter at huske:
* Den specifikke saltforbindelse, der er dannet, afhænger af den anvendte specifikke syre og base.
* Reaktionen vil typisk frigive varme, hvilket indikerer en eksoterm reaktion.
* Salte kan være neutrale, sure eller basiske afhængigt af styrken af den syre og base, der bruges til at danne dem.
Fortæl mig, hvis du har et bestemt salt i tankerne, og jeg kan hjælpe dig med at finde ud af de reaktanter, der er nødvendige for at fremstille det!
 Varme artikler
Varme artikler
-
 Ny komposit fremmer lignin som et fornybart 3-D-printmaterialeEn ny komposit af lignin og nylon ekstruderes let under 3D-print og udviser god mekanisk styrke i færdige produkter. Kredit:Oak Ridge National Laboratory Forskere ved Department of Energys Oak Rid
Ny komposit fremmer lignin som et fornybart 3-D-printmaterialeEn ny komposit af lignin og nylon ekstruderes let under 3D-print og udviser god mekanisk styrke i færdige produkter. Kredit:Oak Ridge National Laboratory Forskere ved Department of Energys Oak Rid -
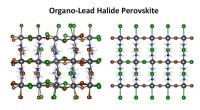 Forskere udvikler innovative teknikker til højopløsningsanalyse af hybridmaterialerSkematisk af organo-blyhalogenidperovskit, der viser forvrængninger fra tilfældige halogenidpositioner (venstre) versus ordnede halogenidpositioner (højre). Et Berkeley Lab-studie viser, at der findes
Forskere udvikler innovative teknikker til højopløsningsanalyse af hybridmaterialerSkematisk af organo-blyhalogenidperovskit, der viser forvrængninger fra tilfældige halogenidpositioner (venstre) versus ordnede halogenidpositioner (højre). Et Berkeley Lab-studie viser, at der findes -
 Sådan optimerer du processen med polymerekstruderingKredit:Pixabay/CC0 Public Domain Ekstrusion er en proces, der er meget udbredt i polymerforarbejdningsindustrien. Det involverer at skubbe materiale gennem en matrice med en bestemt tværsnitsform,
Sådan optimerer du processen med polymerekstruderingKredit:Pixabay/CC0 Public Domain Ekstrusion er en proces, der er meget udbredt i polymerforarbejdningsindustrien. Det involverer at skubbe materiale gennem en matrice med en bestemt tværsnitsform, -
 Nyt værktøj kan hjælpe forskere med at identificere enzymer i mikrobiomerKredit:Kris Snibbe/Harvard University For forskere, der studerer de mulige forbindelser mellem menneskers sundhed og de billioner af mikrober, der bebor vores fordøjelseskanal, det, der gør arbejd
Nyt værktøj kan hjælpe forskere med at identificere enzymer i mikrobiomerKredit:Kris Snibbe/Harvard University For forskere, der studerer de mulige forbindelser mellem menneskers sundhed og de billioner af mikrober, der bebor vores fordøjelseskanal, det, der gør arbejd
- Merkur kunne være den perfekte destination for et solsejl
- Metoden stabiliserer, øger fosforen
- Når energibalance i kroppen er positiv, falder masse?
- Hvordan kan du adskille racemisk blanding?
- Hvad sker der med partiklerne i stof, når en væske vender gas?
- Nanopartikler tilføjet til blodplader fordobler overlevelsesraten for indre skader


