Hvad sker der med partiklerne i stof, når en væske vender gas?
1. Øget kinetisk energi: Partiklerne i en flydende får mere kinetisk energi (bevægelsesenergi). Dette kan ske på grund af en stigning i temperatur eller et fald i trykket.
2. Overvinde intermolekylære kræfter: Partiklerne i en væske holdes sammen af relativt svage intermolekylære kræfter (som hydrogenbinding, dipol-dipolinteraktioner og London-spredningskræfter). Når partiklerne får mere energi, vibrerer de hurtigere og flytter længere fra hinanden og overvinder disse kræfter.
3. Øget adskillelse: Partiklerne bliver bredere fordelt. I en væske er partikler tæt sammen og kan bevæge sig rundt om hinanden. I en gas er partiklerne langt længere fra hinanden og bevæger sig frit og tilfældigt.
4. Ændring i densitet: Substans densitet falder dramatisk. Dette skyldes, at partiklerne i en gas er meget mere spredt end i en væske.
5. Diffusion: Gaspartikler bevæger sig hurtigt og tilfældigt i alle retninger. De kolliderer med hinanden og med væggene i deres beholder, hvilket resulterer i fænomenet diffusion.
Kortfattet: Overgangen fra væske til gas involverer partikler, der får energi, overvinder intermolekylære kræfter, bevæger sig længere fra hinanden, falder i densitet og udviser hurtig, tilfældig bevægelse. Dette er grunden til, at gasser er komprimerbare, besætter hele volumenet af deres beholder og diffunderer let.
 Varme artikler
Varme artikler
-
 Ændring af silkeorms diæt til at spinde stærkere silkeSilkeormen og dens CNF-holdige foder. Kredit:Tohoku University Tohoku University forskere har produceret cellulose nanofiber (CNF) syntetiseret silke naturligt gennem en simpel tweak til silkeorms
Ændring af silkeorms diæt til at spinde stærkere silkeSilkeormen og dens CNF-holdige foder. Kredit:Tohoku University Tohoku University forskere har produceret cellulose nanofiber (CNF) syntetiseret silke naturligt gennem en simpel tweak til silkeorms -
 Opkogning af en æggemaskine skaber en forbedret bakteriedetektorKredit:Pixabay/CC0 Public Domain Traditionelle fluorescerende farvestoffer til at undersøge bakteriers levedygtighed er giftige og lider af dårlig fotostabilitet - men brugen af VFD har gjort de
Opkogning af en æggemaskine skaber en forbedret bakteriedetektorKredit:Pixabay/CC0 Public Domain Traditionelle fluorescerende farvestoffer til at undersøge bakteriers levedygtighed er giftige og lider af dårlig fotostabilitet - men brugen af VFD har gjort de -
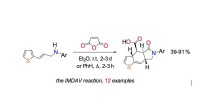 Kemikere foreslår en ny måde at syntetisere steroidanaloger påIntramolekylær Diels-Alder reaktion diskuteret i forskningen. Kredit:Fedor Zubkov Forskere fra RUDN University og Ivan Franko National University of Lviv har fundet en måde at fremstille aromatisk
Kemikere foreslår en ny måde at syntetisere steroidanaloger påIntramolekylær Diels-Alder reaktion diskuteret i forskningen. Kredit:Fedor Zubkov Forskere fra RUDN University og Ivan Franko National University of Lviv har fundet en måde at fremstille aromatisk -
 Implantatinfektioner kan forvises takket være stilladsgennembrudEscherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH Forskere i Irland har taget et stort skridt fremad i kampen mod medicinske implantatinfektioner. De udviklede en ny type implantat
Implantatinfektioner kan forvises takket være stilladsgennembrudEscherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH Forskere i Irland har taget et stort skridt fremad i kampen mod medicinske implantatinfektioner. De udviklede en ny type implantat
- Hvad er to vigtige egenskaber ved den gas, der bruges i kammer en Geiger -tæller?
- Er omvendt relateret til massen af et objekt?
- Telemedicin via satellit forbedrer plejen ved astronautlandinger
- Sådan præciserer du en guldsmelte
- Bevarede blade afslører 7000 års nedbør og tørke
- Hvad er den type EM -stråling, vi modtager fra solen?


