Hvad betyder opløselig i hydroklorsyre?
* opløste: Når et stof opløses, bliver dets partikler (atomer, ioner eller molekyler) jævnt fordelt over opløsningsmidlet (i dette tilfælde HCL).
* Hydrochlorsyre: En stærk syre, der er meget ætsende. Det bruges ofte i laboratorier og industrielle processer.
hvorfor noget kan være opløseligt i HCL:
* Kemiske reaktioner: Mange stoffer reagerer med HCI, nedbryder deres struktur og danner nye forbindelser, der er opløselige i syren. For eksempel reagerer nogle metaller med HCI for at danne metalchlorider, der opløses.
* Polaritet: HCL er et polært molekyle, hvilket betyder, at det har en positiv og negativ ende. Stoffer, der også er polære eller ioniske, er mere tilbøjelige til at opløses i HCI på grund af tiltrækningen mellem deres modsatte afgifter.
Eksempler:
* Metaller: Mange metaller, som zink (Zn), magnesium (Mg) og jern (Fe), er opløselige i HCI.
* carbonater og bicarbonater: Disse forbindelser reagerer med HCI for at producere kuldioxidgas, der frigøres, og et opløseligt salt.
* Oxider: Nogle metaloxider reagerer med HCI for at danne opløselige salte.
Vigtig note:
* Opløselighed i HCI kan variere meget afhængigt af stoffet og koncentrationen af syren.
* Mange reaktioner med HCI er eksoterm (frigørelsesvarme) og kan være ret kraftige.
* Det er vigtigt at håndtere saltsyre med ekstrem forsigtighed på grund af dens ætsende karakter.
Fortæl mig, hvis du vil vide mere om specifikke eksempler eller de involverede kemiske reaktioner.
Sidste artikelHvorfor kan kaliumchlorid bruges som erstatning for natriumchlorid?
Næste artikelHvad er formlen for kobber II oxalat?
 Varme artikler
Varme artikler
-
 Laserbehandling viser potentiale for at reducere industriel kemisk behandling af køretøjerORNL-forsker Adrian Sabau beskriver komponenter i et laserinterferensstruktureringssystem, der blev brugt til at behandle aluminiumslegeringsplader til korrosionsbeskyttelse. Kredit:Carlos Jones/ORNL,
Laserbehandling viser potentiale for at reducere industriel kemisk behandling af køretøjerORNL-forsker Adrian Sabau beskriver komponenter i et laserinterferensstruktureringssystem, der blev brugt til at behandle aluminiumslegeringsplader til korrosionsbeskyttelse. Kredit:Carlos Jones/ORNL, -
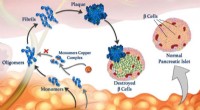 Kobberioner kan spille en nøglerolle, når peptidfoldning går galtKobberioner (røde kugler) kan vedhæfte peptidmonomerer (blå) og forhindre dem i at klumpe sig sammen for at danne oligomerer, fibriller og skadelige plaketter. © 2020 Mawadda Alghrably Afvikling a
Kobberioner kan spille en nøglerolle, når peptidfoldning går galtKobberioner (røde kugler) kan vedhæfte peptidmonomerer (blå) og forhindre dem i at klumpe sig sammen for at danne oligomerer, fibriller og skadelige plaketter. © 2020 Mawadda Alghrably Afvikling a -
 Hvordan bakterier kan genvinde ædle metaller fra batterier til elbilerKredit:Paul Craft/Shutterstock Der er mere end 1,4 milliarder biler i verden i dag, og det tal kan fordobles inden 2036. Hvis alle de biler brænder benzin eller diesel, klimakonsekvenserne vil vær
Hvordan bakterier kan genvinde ædle metaller fra batterier til elbilerKredit:Paul Craft/Shutterstock Der er mere end 1,4 milliarder biler i verden i dag, og det tal kan fordobles inden 2036. Hvis alle de biler brænder benzin eller diesel, klimakonsekvenserne vil vær -
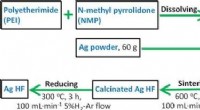 Forskere foreslår en ny metode til at forbedre den elektrokatalytiske omdannelse af kuldioxidDiagram over de detaljerede fremstillingsprocedurer for Ag HF. Kredit:Angewandte Chemie International Edition (2022). DOI:10.1002/anie.202210432 Et forskerhold ledet af Profs. Chen Wei og Wei Wei f
Forskere foreslår en ny metode til at forbedre den elektrokatalytiske omdannelse af kuldioxidDiagram over de detaljerede fremstillingsprocedurer for Ag HF. Kredit:Angewandte Chemie International Edition (2022). DOI:10.1002/anie.202210432 Et forskerhold ledet af Profs. Chen Wei og Wei Wei f
- Hvilken prokaroytisk gruppe beboer ekstreme miljøer?
- Hvordan dannes mønstre i et kalejdoskop?
- Er en pære et eksempel på refleksion eller brydning?
- Vil Twitters giftpille være for hård for Elon Musk at sluge?
- De skubber og træk, der virker på en bygning, blev målt beskrevet i enheder af Newtons, som karak…
- Glasperler i månejord afslører ældgamle asteroidebombardementer på månen og jorden


