Hvilken type binding dannes arsen?
Her er hvorfor:
* Elektronegativitet: Arsen har en elektronegativitet på 2,0, hvilket er relativt højt. Dette betyder, at det tiltrækker elektroner mod sig selv, men ikke stærkt nok til at danne ioniske bindinger.
* Metallisk karakter: Mens arsen udviser nogle metalliske egenskaber, betragtes det primært som en metalloid.
* Limning Præference: Arsen danner let kovalente bindinger med andre ikke -metaller som ilt, klor og svovl. Det danner også kovalente bindinger med metaller, danner arsenider.
Eksempler på arsenforbindelser med kovalente bindinger:
* arsenisk trioxid (AS2O3)
* arsenisk sulfid (AS2S3)
* arsine (Ash3)
Mens arsen kan danne ioniske bindinger i nogle tilfælde, som i arseniderne (f.eks. Na3A'er), er disse mindre almindelige end kovalente bindinger.
 Varme artikler
Varme artikler
-
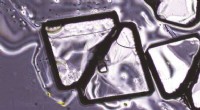 Fælles lægemiddelkilde til indsigt i dannelsen af sommerfuglekrystallerKredit:Australian Nuclear Science and Technology Organisation (ANSTO) Eksperimenter ved ANSTOs australske center for neutronspredning og den australske synkrotron har afsløret vækstmekanismen bag
Fælles lægemiddelkilde til indsigt i dannelsen af sommerfuglekrystallerKredit:Australian Nuclear Science and Technology Organisation (ANSTO) Eksperimenter ved ANSTOs australske center for neutronspredning og den australske synkrotron har afsløret vækstmekanismen bag -
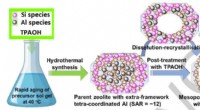 Forskere udvikler hul ZSM-5 zeolitkatalysator med lavt forhold mellem silicium og aluminiumSkematisk illustration af fremstillingen af de mesoporøse ZSM-5-P nanobokse via den hurtige ældning (af precursor sol-gelblandingen) og postsyntetisk TPAOH-behandling. Kredit:IMR ZSM-5 zeolit
Forskere udvikler hul ZSM-5 zeolitkatalysator med lavt forhold mellem silicium og aluminiumSkematisk illustration af fremstillingen af de mesoporøse ZSM-5-P nanobokse via den hurtige ældning (af precursor sol-gelblandingen) og postsyntetisk TPAOH-behandling. Kredit:IMR ZSM-5 zeolit -
 Røntgen tomografi lader forskere se solid-state batterier oplade, udledningSolid-state batterier oplades og aflades i specialfremstillet hardware designet af Georgia Tech. En mindre, modificeret version af cellen vist her blev brugt til at afbilde disse materialer under cykl
Røntgen tomografi lader forskere se solid-state batterier oplade, udledningSolid-state batterier oplades og aflades i specialfremstillet hardware designet af Georgia Tech. En mindre, modificeret version af cellen vist her blev brugt til at afbilde disse materialer under cykl -
 Nedbrydelig ligninbaseret polyurethanadsorbent til effektiv oprensning af råolieGrafisk abstrakt. Kredit: Chemical Engineering Journal (2021). DOI:10.1016/j.cej.2021.128956 En forskergruppe ledet af prof. Zhu Jin ved Ningbo Institute of Materials Technology and Engineering (
Nedbrydelig ligninbaseret polyurethanadsorbent til effektiv oprensning af råolieGrafisk abstrakt. Kredit: Chemical Engineering Journal (2021). DOI:10.1016/j.cej.2021.128956 En forskergruppe ledet af prof. Zhu Jin ved Ningbo Institute of Materials Technology and Engineering (
- Latent varme med hensyn til molekylær opførsel?
- Sker nuklear fission på solen eller fusionen?
- Se proteiner direkte krystalvækst et trin ad gangen (med video)
- Progressive kønssyn kan beskytte økonomisk afhængige mænds sundhed
- Vand-i-salt elektrolyt giver stabil katode til lithium-luft batteridrift
- Hvad er Andesitisk lava?


