Latent varme med hensyn til molekylær opførsel?
Latent varme:Et molekylært perspektiv
Latent varme er den energi, der absorberes eller frigives under en faseændring, hvor temperaturen forbliver konstant. Denne energi ændrer ikke temperaturen på stoffet, men ændrer i stedet arrangementet af dets molekyler og ændrer dens fysiske tilstand (fast, flydende eller gas).
Sådan fungerer det på et molekylært niveau:
1. Breaking and Forming Bonds:
* smeltning og fordampning: Under smeltning og fordampning absorberes energi for at overvinde de attraktive kræfter, der holder molekylerne sammen i en fast eller flydende tilstand. Disse kræfter er stærkere i faste stoffer end i væsker, hvilket forklarer, hvorfor den latente fusionsvarme (smeltning) typisk er lavere end den latente fordampningsvarme.
* Frysning og kondens: Under frysning og kondens frigøres energi, når molekylerne arrangerer sig i en mere ordnet tilstand, der danner stærkere intermolekylære bindinger.
2. Molekylær bevægelse:
* faste stoffer: Molekyler i faste stoffer har en fast position og vibrerer omkring disse positioner. De har begrænset bevægelsesfrihed og holdes sammen af stærke intermolekylære kræfter.
* væsker: Molekyler i væsker har mere bevægelsesfrihed sammenlignet med faste stoffer. De kan bevæge sig inden i væsken og holdes sammen af svagere intermolekylære kræfter.
* Gasser: Molekyler i gasser har mest bevægelsesfrihed. De er langt fra hinanden og bevæger sig hurtigt og tilfældigt. De har ubetydelige intermolekylære kræfter.
3. Energiændringer:
* Tilføjelse af latent varme: Når latent varme tilsættes, bruges energiindgangen til at bryde intermolekylære bindinger og øge den gennemsnitlige kinetiske energi for molekylerne, hvilket fører til en ændring i fasen af stoffet. Temperaturen forbliver konstant under denne proces, fordi energien går i omarrangering af molekylerne og ikke øger deres kinetiske energi.
* frigørelse af latent varme: Når latent varme frigøres, afgives energi, da molekyler danner stærkere bindinger og bremser. Denne ændring i stoffet tilstand påvirker ikke direkte den gennemsnitlige kinetiske energi, og derfor forbliver temperaturen konstant.
Eksempel:Vand
* Meltis: Når is smelter, bryder energiindgangen brintbindingerne, der holder vandmolekylerne i en stiv gitterstruktur. Dette gør det muligt for molekylerne at bevæge sig mere frit og skifte til en flydende tilstand.
* kogende vand: Når vand koger, bryder energiindgangen brintbindingerne, der holder vandmolekylerne tæt sammen i flydende tilstand. Molekylerne slipper ud i gasfasen og bliver vanddamp.
Kortfattet:
Latent varme er energien forbundet med at bryde eller danne intermolekylære bindinger, hvilket er en nøglefaktor, der bestemmer stoffasen. Det er direkte relateret til den molekylære opførsel og den energi, der kræves for at ændre arrangementet af molekyler inden for et stof.
Sidste artikelHvilke subatomære partikler gør et element reaktivt?
Næste artikelHvilken type reaktion frigiver den mest energi?
 Varme artikler
Varme artikler
-
 Lithium-ioner strømmer gennem fast materialeLithiumioner diffunderer hurtigt inden for gitteret af en stærkt korreleret perovskit kaldet samariumnikkelat. Kvanteberegninger viser, at denne hurtige shuttle opstår på grund af den lave termodynami
Lithium-ioner strømmer gennem fast materialeLithiumioner diffunderer hurtigt inden for gitteret af en stærkt korreleret perovskit kaldet samariumnikkelat. Kvanteberegninger viser, at denne hurtige shuttle opstår på grund af den lave termodynami -
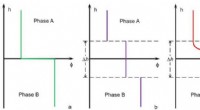 Forskere afslører naturen af jordvand og dets faseovergangFig. 1. De abstrakte grænseflademodeller mellem fase A og fase B. a:den skarpe Gibbs-grænseflademodel; b:den ensartede grænseflademodel; c:modellen med diffuse grænseflader. h er grænsefladetykkelsen.
Forskere afslører naturen af jordvand og dets faseovergangFig. 1. De abstrakte grænseflademodeller mellem fase A og fase B. a:den skarpe Gibbs-grænseflademodel; b:den ensartede grænseflademodel; c:modellen med diffuse grænseflader. h er grænsefladetykkelsen. -
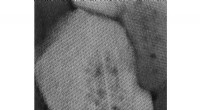 Materialeforskere går nærmere ind på sårbarheder involveret i menneskeligt tandfaldVerdens mindste sandwich. Et atomopløsnings scanningstransmissionselektronmikroskopibillede af en emalje krystallit, der kigger ned ad krystallens lange akse. De mørke områder viser magnesiumioner, de
Materialeforskere går nærmere ind på sårbarheder involveret i menneskeligt tandfaldVerdens mindste sandwich. Et atomopløsnings scanningstransmissionselektronmikroskopibillede af en emalje krystallit, der kigger ned ad krystallens lange akse. De mørke områder viser magnesiumioner, de -
 Gennem tykt og tyndt:Neutroner sporer lithium-ioner i batterielektroderKemiingeniørforskere fra University of Virginia School of Engineering anvender neutronbilleddannelse ved Oak Ridge National Laboratory til at undersøge lithium-ion-batterimaterialer og -strukturer. Kr
Gennem tykt og tyndt:Neutroner sporer lithium-ioner i batterielektroderKemiingeniørforskere fra University of Virginia School of Engineering anvender neutronbilleddannelse ved Oak Ridge National Laboratory til at undersøge lithium-ion-batterimaterialer og -strukturer. Kr


