Hvilke subatomære partikler gør et element reaktivt?
* Valenselektroner: Disse elektroner er dem, der deltager i kemisk binding. De er længst fra kernen og oplever den svageste tiltrækning til den.
* octet regel: Atomer har en tendens til at være mest stabile, når de har otte elektroner i deres valensskal (bortset fra brint og helium, som har brug for to). Dette er kendt som Octet -reglen.
* reaktivitet: Elementer med ufuldstændige valensskaller er meget reaktive, fordi de søger at vinde, miste eller dele elektroner for at opnå en stabil oktet. Dette får dem til at deltage i kemiske reaktioner.
* Metaller: Metaller har typisk 1-3 valenselektroner. De har en tendens til at miste disse elektroner for at blive positivt ladede ioner og danne ioniske bindinger med ikke -metaller.
* ikke -metaller: Ikke-metaller har typisk 5-7 valenselektroner. De har en tendens til at få elektroner til at blive negativt ladede ioner og danne ioniske bindinger med metaller.
* Metalloider: Metalloider har egenskaber for både metaller og ikke -metaller og udviser forskellige grader af reaktivitet.
Eksempel:
* natrium (NA) Har en valenselektron. Det mister let dette elektron for at danne en positiv ion (Na+) og opnå en stabil elektronkonfiguration.
* klor (Cl) Har syv valenselektroner. Det får let en elektron til at danne en negativ ion (CL-) og opnå en stabil elektronkonfiguration.
Kortfattet: Antallet og arrangementet af valenselektroner bestemmer et elements reaktivitet. Elementer med ufuldstændige valensskaller er mere tilbøjelige til at deltage i kemiske reaktioner for at opnå en stabil octet.
Sidste artikelHvornår drejer solide lige ind i en gas?
Næste artikelLatent varme med hensyn til molekylær opførsel?
 Varme artikler
Varme artikler
-
 I skridt mod autonome materialer, forskere designer mønstre i selvkørende flydende krystallerNy forskning viser, at bevægelsen i flydende krystaller kan udnyttes og ledes, et skridt i retning af at udvikle autonome materialer, der kan fornemme input, forstærke signaler, og endda beregne oplys
I skridt mod autonome materialer, forskere designer mønstre i selvkørende flydende krystallerNy forskning viser, at bevægelsen i flydende krystaller kan udnyttes og ledes, et skridt i retning af at udvikle autonome materialer, der kan fornemme input, forstærke signaler, og endda beregne oplys -
 Et biomasse-til-væske-anlæg til fremstilling af bæredygtigt syntetisk brændstofKredit:Gunther Kolb Et EU-projekt udviklede innovative nanokatalysatorer for at skabe en integreret modulær og højeffektiv proces til fremstilling af brændstoffer fra vedvarende energikilder. Kli
Et biomasse-til-væske-anlæg til fremstilling af bæredygtigt syntetisk brændstofKredit:Gunther Kolb Et EU-projekt udviklede innovative nanokatalysatorer for at skabe en integreret modulær og højeffektiv proces til fremstilling af brændstoffer fra vedvarende energikilder. Kli -
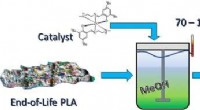 Kemisk genbrug gør nyttigt produkt fra affald bioplastKredit:ACS En hurtigere, en mere effektiv måde at genanvende plantebaseret bioplastik er blevet udviklet af et team af forskere ved universiteterne i Birmingham og Bath. Teamet har vist, hvordan
Kemisk genbrug gør nyttigt produkt fra affald bioplastKredit:ACS En hurtigere, en mere effektiv måde at genanvende plantebaseret bioplastik er blevet udviklet af et team af forskere ved universiteterne i Birmingham og Bath. Teamet har vist, hvordan -
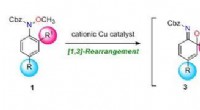 Effektiv syntese af multisubstituerede aniliner ved domino-omlejringMultisubstituerede aniliner (ortho-anisidiner). Kredit:Tohoku University Aniliner er blevet meget brugt i medicin, især i acetaminophen smertestillende midler. De bruges også i organiske materiale
Effektiv syntese af multisubstituerede aniliner ved domino-omlejringMultisubstituerede aniliner (ortho-anisidiner). Kredit:Tohoku University Aniliner er blevet meget brugt i medicin, især i acetaminophen smertestillende midler. De bruges også i organiske materiale


