Faste metaller gennemgår større termisk ekspansion end væsker gør?
væsker gennemgår generelt større termisk ekspansion end faste stoffer.
Her er hvorfor:
* Partikelarrangement: I faste stoffer er partikler tæt pakket og holdes sammen af stærke intermolekylære kræfter. Dette begrænser deres bevægelse og begrænser udvidelsen. Væsker har svagere intermolekylære kræfter, og deres partikler er mere løst pakket, hvilket muliggør større fri bevægelighed og ekspansion.
* Intermolekylære kræfter: De intermolekylære kræfter i faste stoffer er generelt stærkere end i væsker. Når der påføres varme, har molekylerne i faste stoffer mindre frihed til at bevæge sig fra hinanden på grund af disse stærke kræfter.
Eksempel: Overvej vand. Når vand opvarmes, udvides det som en væske. Men når vand fryser til is (en fast), udvides det faktisk på grund af den stive krystallinske struktur dannet af vandmolekylerne.
Undtagelser: Der er nogle undtagelser fra denne generelle regel. Visse materialer som gummi udviser høj termisk ekspansion på grund af deres unikke molekylstruktur. Generelt viser væsker større termisk ekspansion end faste stoffer.
 Varme artikler
Varme artikler
-
 Evaluering af nye behandlingsplatforme til farmaceutisk produktionKredit:Olivia Morales Gonzales Medicinalindustrien er en af de mest relevante sektorer i nutidens økonomi. I mere end et århundrede har den farmaceutiske produktion været afhængig af batchprodukt
Evaluering af nye behandlingsplatforme til farmaceutisk produktionKredit:Olivia Morales Gonzales Medicinalindustrien er en af de mest relevante sektorer i nutidens økonomi. I mere end et århundrede har den farmaceutiske produktion været afhængig af batchprodukt -
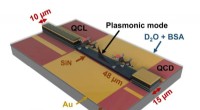 Miniaturiseret lab-on-a-chip til kemisk analyse af væsker i realtidOn-chip sensorkoncept inklusive angivet plasmonisk tilstand. Emitter (QCL, 10 μm bred) og detektor (QCD, 15 μm bred) er forbundet gennem en 48 μm lang tilspidset SiN-baseret plasmonisk bølgeleder. Hel
Miniaturiseret lab-on-a-chip til kemisk analyse af væsker i realtidOn-chip sensorkoncept inklusive angivet plasmonisk tilstand. Emitter (QCL, 10 μm bred) og detektor (QCD, 15 μm bred) er forbundet gennem en 48 μm lang tilspidset SiN-baseret plasmonisk bølgeleder. Hel -
 Direkte omdannelse af CH3Cl til eddikesyre gennem en carbonyleringsreaktionMeget selektiv carbonylering af CH3 Cl til eddikesyre katalyseret af pyridinbehandlet MOR-zeolit. Kredit:Fang Xudong Metan, hovedbestanddelen af naturgas, skifergas og brændbar is, er et rent og
Direkte omdannelse af CH3Cl til eddikesyre gennem en carbonyleringsreaktionMeget selektiv carbonylering af CH3 Cl til eddikesyre katalyseret af pyridinbehandlet MOR-zeolit. Kredit:Fang Xudong Metan, hovedbestanddelen af naturgas, skifergas og brændbar is, er et rent og -
 Direkte observation af desorption af en smelte af lange polymerkæderKredit:CC0 Public Domain I vores hverdag er det ikke ualmindeligt at se det samme materiale i forskellige tilstande. Tag for eksempel vand:det er en væske ved omgivelsestemperatur, vi kan omdanne
Direkte observation af desorption af en smelte af lange polymerkæderKredit:CC0 Public Domain I vores hverdag er det ikke ualmindeligt at se det samme materiale i forskellige tilstande. Tag for eksempel vand:det er en væske ved omgivelsestemperatur, vi kan omdanne
- Hvad er et andet ord for infrarød energi?
- Er landformerne i Mellemamerika blevet formet af tektoniske processer?
- Hvorfor seksuel vold mod mænd fra kvinders side også skal "kaldes ud".
- Ledere overvurderer vildt de økonomiske fordele ved strategiplanlægning
- Formularer, når vanddamp ændres til fast?
- Hvorfor væsker skifter volumen, men gasser kan?


