Hvorfor kan partiklerne af gas ændre sig og faste stoffer ikke?
Gasser:
* Arrangement: Partikler er langt fra hinanden og tilfældigt arrangeret.
* Bevægelse: Partikler bevæger sig meget hurtigt og frit i alle retninger og kolliderer med hinanden og containervæggene.
* Ændringer: På grund af deres høje kinetiske energi kan gaspartikler let sprede sig for at fylde enhver beholder, de er i. De er også komprimerbare, hvilket betyder, at deres volumen kan ændre sig markant med tryk.
faste stoffer:
* Arrangement: Partikler er tæt pakket i et almindeligt, gentagende mønster (som en krystalgitter).
* Bevægelse: Partikler vibrerer i faste positioner med begrænset bevægelse.
* Ændringer: Mens individuelle partikler vibrerer, forbliver deres samlede arrangement stort set fast. Dette giver faste stoffer en bestemt form og volumen. De komprimeres ikke let.
Den vigtigste forskel:
styrken af kræfterne til attraktion mellem partikler bestemmer deres tilstand.
* I gasser er disse kræfter meget svage.
* I faste stoffer er disse kræfter meget stærke.
Dette er grunden til, at gaspartikler kan bevæge sig frit, mens faste partikler holdes i en fast struktur.
Vigtig note: Det er værd at nævne, at selv faste stoffer har en vis grad af partikelbevægelse. Dette er grunden til, at faste stoffer udvides, når det opvarmes. Den øgede energi giver partikler mulighed for at vibrere med større amplitude, hvilket fører til en lille ekspansion. Den overordnede struktur forbliver imidlertid intakt.
Sidste artikelHvorfor bruges platin til at måle temperatur?
Næste artikelHvordan påvirker densiteten af molekyler varmeoverførsel?
 Varme artikler
Varme artikler
-
 Ingeniører 3-D print højstyrke aluminium, løse ældgamle svejseproblem ved hjælp af nanopartikle…Med denne spændende nye teknik, HRL står i spidsen for et nyt kapitel i additiv fremstilling af metaller til forskning, industri, og forsvar. Kredit:M. Durant HRL Laboratories HRL Laboratories har
Ingeniører 3-D print højstyrke aluminium, løse ældgamle svejseproblem ved hjælp af nanopartikle…Med denne spændende nye teknik, HRL står i spidsen for et nyt kapitel i additiv fremstilling af metaller til forskning, industri, og forsvar. Kredit:M. Durant HRL Laboratories HRL Laboratories har -
 Nyligt forbedret glasglas gør mikroskoper til termometreEt foto af eksperimentet med et objektglas med den nye belægning. Kredit:University at Buffalo Det ydmyge mikroskopobjektglas i glas kan primes til en makeover. En undersøgelse offentliggjort onl
Nyligt forbedret glasglas gør mikroskoper til termometreEt foto af eksperimentet med et objektglas med den nye belægning. Kredit:University at Buffalo Det ydmyge mikroskopobjektglas i glas kan primes til en makeover. En undersøgelse offentliggjort onl -
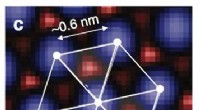 Scanning af overfladen af lithiumtitanatDen tredobbelte symmetri, der er angivet her, afslører spinelkrystalstrukturen. Kredit:Taro Hitosugi, Naturkommunikation Forskere ved Tokyo Institute of Technology, Tohoku University og Universi
Scanning af overfladen af lithiumtitanatDen tredobbelte symmetri, der er angivet her, afslører spinelkrystalstrukturen. Kredit:Taro Hitosugi, Naturkommunikation Forskere ved Tokyo Institute of Technology, Tohoku University og Universi -
 En type halvgennemsigtig polymer, der kan repareres ved stuetemperatur ved hjælp af lille trykKredit:Yu Yanagisawa Et lille team af forskere ved University of Tokyo har skabt en polymer, der kan repareres, når den brydes i to dele ved at påføre et lille tryk ved stuetemperatur. I deres pap
En type halvgennemsigtig polymer, der kan repareres ved stuetemperatur ved hjælp af lille trykKredit:Yu Yanagisawa Et lille team af forskere ved University of Tokyo har skabt en polymer, der kan repareres, når den brydes i to dele ved at påføre et lille tryk ved stuetemperatur. I deres pap
- Kraftige følelser påvirker, hvordan vælgere søger politisk information
- Er eddikesyre en stærk elektrolyt?
- Hvad hedder Compound Fe2O2?
- Beregning af naturbegivenheders indvirkning på dyrelivet
- Forskere identificerer nøglefaktorer, der hjælper mikrober med at trives i barske miljøer
- Hvordan skaber Jordens bevægelse rundt om solen sæsoner?


