Er densiteten af gasformigt stof sandsynligvis større eller mindre end flydende fast stof ved samme temperatur, og hvorfor?
* afstand af molekyler: I gasser er molekyler bredt fordelt og bevæger sig frit. Dette betyder, at der er en masse tom plads mellem molekylerne. I væsker er molekyler tættere sammen, og i faste stoffer er de tæt pakket.
* Intermolekylære kræfter: Kræfterne til tiltrækning mellem molekyler (intermolekylære kræfter) er meget svagere i gasser end i væsker eller faste stoffer. Dette gør det muligt for gasmolekyler at bevæge sig mere frit og optage et større volumen.
densitet defineres som masse pr. Enhedsvolumen:
* Gasser: Den lave tæthed af gasser skyldes det store volumen, de optager for en given masse, på grund af afstanden mellem molekyler.
* væsker og faste stoffer: Den højere tæthed af væsker og faste stoffer er fordi molekylerne er pakket meget tættere sammen, hvilket fører til et mindre volumen for en given masse.
Eksempel:
Forestil dig en ballon fyldt med luft. Luften inde i ballonen er en gas. Forestil dig nu at presse ballonen. Luftmolekylerne tvinges tættere sammen, hvilket øger densiteten. Dette viser, hvordan ændring af afstand mellem molekyler direkte påvirker densiteten.
Kortfattet: Forskellen i densitet mellem gasser, væsker og faste stoffer ved den samme temperatur skyldes primært de forskellige afstand og arrangement af molekyler i hver tilstand.
 Varme artikler
Varme artikler
-
 Hvordan man udvider og kontraherer buede overflader af alle formerForskere ved TU Delfts afdeling for Precision and Microsystems Engineering (PME) har designet en dilatationsmetode, som kan anvendes på enhver buet overflade. Denne universelle metode kan have en rækk
Hvordan man udvider og kontraherer buede overflader af alle formerForskere ved TU Delfts afdeling for Precision and Microsystems Engineering (PME) har designet en dilatationsmetode, som kan anvendes på enhver buet overflade. Denne universelle metode kan have en rækk -
 Spinding af planteaffald til kulfiber til biler, flyLignin. Billede:Wikipedia Brug af planter og træer til at fremstille produkter som papir eller ethanol efterlader en rest kaldet lignin, en komponent af plantecellevægge. Den rest af lignin er ikk
Spinding af planteaffald til kulfiber til biler, flyLignin. Billede:Wikipedia Brug af planter og træer til at fremstille produkter som papir eller ethanol efterlader en rest kaldet lignin, en komponent af plantecellevægge. Den rest af lignin er ikk -
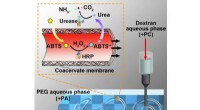 Materialeforskere bygger et syntetisk system med rum som rigtige cellerUMass Amherst materialeforsker Thomas Russell og andre beskriver i et nyt papir, hvordan de drager fordel af forskelle i elektrisk ladning til at skabe en alt vandig, vand-i-vand-konstruktion, der opn
Materialeforskere bygger et syntetisk system med rum som rigtige cellerUMass Amherst materialeforsker Thomas Russell og andre beskriver i et nyt papir, hvordan de drager fordel af forskelle i elektrisk ladning til at skabe en alt vandig, vand-i-vand-konstruktion, der opn -
 Forskere genopdager hurtigtvirkende tysk insekticid tabt i kølvandet på Anden VerdenskrigEn monofluoranalog af DDT, set gennem et optisk mikroskop. Faste fluorerede former for DDT dræbte insekter hurtigere end DDT. Kredit:Xiaolong Zhu og Jingxiang Yang, NYU Institut for Kemi En ny und
Forskere genopdager hurtigtvirkende tysk insekticid tabt i kølvandet på Anden VerdenskrigEn monofluoranalog af DDT, set gennem et optisk mikroskop. Faste fluorerede former for DDT dræbte insekter hurtigere end DDT. Kredit:Xiaolong Zhu og Jingxiang Yang, NYU Institut for Kemi En ny und


