Hvorfor er densiteten af et stof i gasformet tilstand meget mindre end dets væske eller fast tilstand?
1. Større interpartikelafstand: I gasser er molekylerne langt fra hinanden sammenlignet med væsker og faste stoffer. Denne store afstand skyldes de svage intermolekylære kræfter mellem gasmolekyler.
2. Høj kinetisk energi: Gasmolekyler har høj kinetisk energi, hvilket fører til konstant, hurtig bevægelse. Denne bevægelse resulterer i kollisioner og holder molekylerne adskilt, hvilket yderligere bidrager til den lave tæthed.
3. Kompressibilitet: Gasser er meget komprimerbare på grund af de store tomme rum mellem molekyler. Når der påføres tryk, tvinges molekylerne tættere sammen, reducerer volumenet og øger densiteten. Selv under tryk er en gas densitet imidlertid markant lavere end dens væske eller fast tilstand.
4. Fyld hele lydstyrken: Gasmolekyler bevæger sig frit og besætter hele volumenet af deres beholder. Dette betyder, at molekylerne er spredt over et meget større rum, hvilket fører til en lavere densitet.
5. Temperaturafhængighed: Gasser af densitet er meget afhængig af temperaturen. Efterhånden som temperaturen stiger, øges molekylernes kinetiske energi, hvilket resulterer i større adskillelse og lavere densitet.
Sammenfattende er den lavere densitet af gasser en konsekvens af den store interpartikelafstand, høj kinetisk energi, kompressibilitet og gasmolekylernes evne til at fylde hele volumenet på deres beholder.
 Varme artikler
Varme artikler
-
 Forskere ramte protein- og lipidsammensætningen af den sibiriske mammutknogleKredit:@tsarcyanide/MIPT Forskere fra Skoltech og Moskva Institut for Fysik og Teknologi (MIPT) undersøgte protein- og lipidsammensætningen af en mammutknogle fundet nær Yana -floden i det nordø
Forskere ramte protein- og lipidsammensætningen af den sibiriske mammutknogleKredit:@tsarcyanide/MIPT Forskere fra Skoltech og Moskva Institut for Fysik og Teknologi (MIPT) undersøgte protein- og lipidsammensætningen af en mammutknogle fundet nær Yana -floden i det nordø -
 Multipel myrelignende transport af neuronal last med motorproteinerGodstransport med mange motorer gør neuronal aktivitet fin. Kredit:Kumiko Hayashi Mikrotubuli er veje lavet af proteiner, der strækker sig gennem en celle for motorproteiner (bærere) til at levere
Multipel myrelignende transport af neuronal last med motorproteinerGodstransport med mange motorer gør neuronal aktivitet fin. Kredit:Kumiko Hayashi Mikrotubuli er veje lavet af proteiner, der strækker sig gennem en celle for motorproteiner (bærere) til at levere -
 Mod en miljøvenlig produktion af aktive farmaceutiske ingredienser med en flowreaktorProf. Dr. Harald Gröger arbejder i ONE-FLOW på en måde at producere kemiske forbindelser gennem kombination af bio- og kemokatalyse i flowreaktorer. De kemiske reaktioner udføres f.eks. I moduler med
Mod en miljøvenlig produktion af aktive farmaceutiske ingredienser med en flowreaktorProf. Dr. Harald Gröger arbejder i ONE-FLOW på en måde at producere kemiske forbindelser gennem kombination af bio- og kemokatalyse i flowreaktorer. De kemiske reaktioner udføres f.eks. I moduler med -
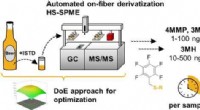 Sniffing af frugtagtige thioler i hoppede ølKredit:American Chemical Society Hoppy øl som blege øl bliver stadig mere populære. En grund er deres behagelige frugtagtige aroma, der delvist stammer fra forbindelser kaldet thioler. Bryggerier
Sniffing af frugtagtige thioler i hoppede ølKredit:American Chemical Society Hoppy øl som blege øl bliver stadig mere populære. En grund er deres behagelige frugtagtige aroma, der delvist stammer fra forbindelser kaldet thioler. Bryggerier
- Forskning undersøger variabiliteten af den ultraluminøse røntgenkilde NGC 925 ULX-3
- Forskere forudsiger rullende bevægelse med stor amplitude til sikrere hav
- Hvordan fjernes olie og naturgas fra jordskorpen?
- Nanozymer driver tumor-specifik lægemiddellevering, mens de minimerer toksicitet
- Hvad sker der, når du opvarmer kobberchlorid?
- Her er tre måder, hvorpå byer kan tilpasse sig skiftende klimaer


