Diffusion forekommer både i væsker og gasser, men næppe overhovedet faste stoffer?
1. Partikelbevægelse:
* Gasser: Gaspartikler har mest bevægelsesfrihed. De er langt fra hinanden, bevæger sig hurtigt og kolliderer ofte. Denne høje kinetiske energi og mangel på stærke intermolekylære kræfter gør diffusion hurtig og effektiv.
* væsker: Flydende partikler har en vis bevægelsesfrihed. De er tættere på hinanden end gaspartikler, men kan stadig bevæge sig forbi hinanden. Dette giver mulighed for diffusion, selvom det er langsommere end i gasser.
* faste stoffer: Faste partikler er tæt pakket og har meget begrænset bevægelse. Deres vibrationsenergi er ikke nok til at overvinde de stærke intermolekylære kræfter, der holder dem i en fast gitterstruktur. Dette gør diffusion ekstremt langsom.
2. Intermolekylære kræfter:
* Gasser: Svage intermolekylære kræfter giver partikler mulighed for at bevæge sig frit.
* væsker: Intermolekylære kræfter er stærkere end i gasser, men giver stadig mulighed for en vis partikelbevægelse.
* faste stoffer: Stærke intermolekylære kræfter holder partikler i faste positioner, hvilket gør diffusion ekstremt vanskelig.
3. Densitet:
* Gasser: Lav tæthed gør det muligt for partikler at bevæge sig mere frit og støde på mindre modstand under diffusion.
* væsker: Væsker har en højere densitet end gasser, hvilket fører til flere kollisioner og langsommere diffusion.
* faste stoffer: Faststoffer har den højeste tæthed, hvilket gør diffusion næsten umulig.
Mens diffusion i faste stoffer er meget langsom, er det ikke helt fraværende. Der er tilfælde, hvor diffusion i faste stoffer kan forekomme, omend til ekstremt langsomme satser:
* metallegeringer: Atomer af forskellige metaller kan langsomt diffundere til hinanden og ændre egenskaberne for legeringen over lange perioder.
* Høje temperaturer: Ved høje temperaturer kan vibrationsenergien af faste partikler overvinde nogle af de intermolekylære kræfter, hvilket muliggør en svag stigning i diffusion.
Afslutningsvis skyldes forskellen i diffusionshastigheder mellem faste stoffer, væsker og gasser primært forskellene i partikelbevægelse, intermolekylære kræfter og densitet.
 Varme artikler
Varme artikler
-
 Fotokemisk deracemisering af chirale forbindelser opnåetEnantiomere molekyler ligner hinanden som højre og venstre hånd. Mens begge varianter normalt opstår i kemiske reaktioner, ofte er kun en af dem effektiv inden for biologi og medicin. Hidtil, fuldst
Fotokemisk deracemisering af chirale forbindelser opnåetEnantiomere molekyler ligner hinanden som højre og venstre hånd. Mens begge varianter normalt opstår i kemiske reaktioner, ofte er kun en af dem effektiv inden for biologi og medicin. Hidtil, fuldst -
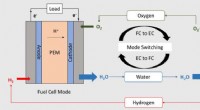 Ny katalysator hjælper med at kombinere brændselscelle, batteri i én enhedKredit:Washington University i St. Louis En enkelt enhed, der både genererer brændstof og oxidant fra vand og, når en kontakt drejes, omdanner brændstof og ilt til elektricitet og vand, har en ræk
Ny katalysator hjælper med at kombinere brændselscelle, batteri i én enhedKredit:Washington University i St. Louis En enkelt enhed, der både genererer brændstof og oxidant fra vand og, når en kontakt drejes, omdanner brændstof og ilt til elektricitet og vand, har en ræk -
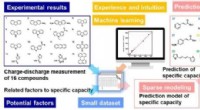 Bedste ydeevne af organisk materiale til lithiumbatterianode ved brug af materialeinformatikAccelereret opdagelse af højtydende organisk anode baseret på eksperimentorienteret MI. Kredit:© Yuya Oaki På JST Strategic Basic Research Programs, forskningsgruppen ledet af lektor Yuya Oaki og
Bedste ydeevne af organisk materiale til lithiumbatterianode ved brug af materialeinformatikAccelereret opdagelse af højtydende organisk anode baseret på eksperimentorienteret MI. Kredit:© Yuya Oaki På JST Strategic Basic Research Programs, forskningsgruppen ledet af lektor Yuya Oaki og -
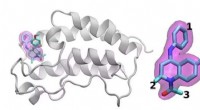 Forskningsgruppen bruger supercomputing til at målrette de mest lovende lægemiddelkandidater ud fr…En skematisk oversigt over BRD4 -proteinet bundet til et af 16 lægemidler baseret på det samme tetrahydroquinolin -stillads (fremhævet i magenta). Regioner, der er kemisk modificeret mellem de lægemid
Forskningsgruppen bruger supercomputing til at målrette de mest lovende lægemiddelkandidater ud fr…En skematisk oversigt over BRD4 -proteinet bundet til et af 16 lægemidler baseret på det samme tetrahydroquinolin -stillads (fremhævet i magenta). Regioner, der er kemisk modificeret mellem de lægemid
- Hvordan vokser din have?
- Hvad sker der med kræfterne til tiltrækning mellem ladede genstande og uladet, når afstand dem fa…
- Hvilken type binding findes mellem aluminium og arsen?
- Amazon bevarer det bedste brands omdømme, Apple og Google reps dukkert
- Hvad er en energioverførsel på grund af en forskel i temperatur?
- Er der nogen jordbaserede ultraviolette observationer?


