Hvordan påvirker Heatig bevægelsen af molekyler en gas?
1. Øget kinetisk energi:
* Temperatur er et mål for gennemsnitlig kinetisk energi. Når du opvarmer en gas, tilføjer du i det væsentlige energi til dens molekyler. Denne energi absorberes primært som *kinetisk energi *, bevægelsesenergien.
* Når molekyler absorberer mere kinetisk energi, bevæger de sig hurtigere. Dette betyder, at deres gennemsnitlige hastighed øges .
2. Hyppigere og energiske kollisioner:
* Hurtigere bevægende molekyler kolliderer hyppigere med hinanden og væggene i deres beholder.
* Disse kollisioner er også mere energiske på grund af den øgede hastighed.
3. Øget tryk:
* Den øgede frekvens og energi af kollisioner med containervæggene resulterer i et højere tryk . Tænk på en ballon:Hvis du opvarmer luften inde, vil ballonen udvide, fordi det øgede tryk inde i skubber mod de elastiske vægge.
4. Udvidelse:
* I en beholder med et fast volumen har det øgede tryk fra opvarmede gasmolekyler ingen steder at gå hen. Men hvis beholderen er fleksibel, som en ballon, får det øgede tryk beholderen til at udvide.
* Hvis gassen er i en åben beholder, vil det øgede tryk få gassen til at udvide ind i det omgivende rum.
5. Ændringer i tilstand:
* Hvis du fortsætter med at tilføje varme til en gas, vil molekylerne til sidst få nok energi til at overvinde de attraktive kræfter, der holder dem sammen. På dette tidspunkt kan gassen skifte til en væske eller endda en fast tilstand.
Kortfattet:
Opvarmning af en gas øger dens kinetiske energi fra dens molekyler, hvilket får dem til at bevæge sig hurtigere, kollidere oftere og med større kraft. Dette fører til øget pres og potentielt ekspansion. Det ekstreme tilfælde af opvarmning kan endda føre til en ændring i materien.
Sidste artikelHvad er egenskaber, der varierer mellem subatomære partikler?
Næste artikelHvad er princippet om gastermometer?
 Varme artikler
Varme artikler
-
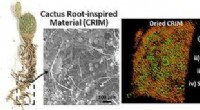 Kaktusrødder inspirerer til skabelse af vandfastholdende materialeKredit:American Chemical Society Under sjældne ørkenregn, kaktusser spilder ingen tid med at suge op og gemme en storms dyrebare nedbør. Inspireret af dette naturfænomen, videnskabsmænd rapportere
Kaktusrødder inspirerer til skabelse af vandfastholdende materialeKredit:American Chemical Society Under sjældne ørkenregn, kaktusser spilder ingen tid med at suge op og gemme en storms dyrebare nedbør. Inspireret af dette naturfænomen, videnskabsmænd rapportere -
 Biokemisk superlim åbner en ny tilgang til vaccineudviklingKredit:University of Oxford Et spinoutfirma fra Oxford University er ved at udvikle en molekylær superlim til hurtig udvikling af vacciner rettet mod en række sygdomme. SpyBiotech bruger biokemis
Biokemisk superlim åbner en ny tilgang til vaccineudviklingKredit:University of Oxford Et spinoutfirma fra Oxford University er ved at udvikle en molekylær superlim til hurtig udvikling af vacciner rettet mod en række sygdomme. SpyBiotech bruger biokemis -
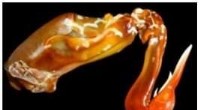 Mantis-rejeklubbens mangefacetterede design er inspirerende avancerede kompositmaterialer til fly, f…Et tværsnit af mantis-rejeklubben viser den stribede region, der var karakteriseret af UCR-forskere. Denne region består af en unik struktur, der vikler sig rundt om køllen for at beskytte den mod sel
Mantis-rejeklubbens mangefacetterede design er inspirerende avancerede kompositmaterialer til fly, f…Et tværsnit af mantis-rejeklubben viser den stribede region, der var karakteriseret af UCR-forskere. Denne region består af en unik struktur, der vikler sig rundt om køllen for at beskytte den mod sel -
 Fysiker skaber N95-type åndedrætsværn ved hjælp af en bomuldsmaskineKredit:Pixabay/CC0 Public Domain Mahesh Bandi, en fysiker med den ikke-lineære og ikke-ligevægtsfysikenhed, OIST Graduate University, Onna, Okinawa, har fundet en måde at fremstille N95-type respi
Fysiker skaber N95-type åndedrætsværn ved hjælp af en bomuldsmaskineKredit:Pixabay/CC0 Public Domain Mahesh Bandi, en fysiker med den ikke-lineære og ikke-ligevægtsfysikenhed, OIST Graduate University, Onna, Okinawa, har fundet en måde at fremstille N95-type respi


