Hvordan blev det bevist, at hele messen af et atom er placeret i midten?
1. Rutherfords Gold Foil Experiment (1911):
* opsætning: Ernest Rutherford bombarderede et tyndt ark guldfolie med alfa -partikler (positivt ladede partikler udsendt af radioaktive materialer).
* Observation: De fleste alfa -partikler passerede lige gennem folien, men nogle få blev afbøjet i store vinkler, nogle hoppede endda tilbage.
* Konklusion: Rutherford konkluderede, at atomet skal have et tæt, positivt ladet center, som han kaldte kernen . Det faktum, at de fleste alfa -partikler passerede igennem, antydede, at atomet for det meste er tomt rum.
* Betydning: Dette eksperiment beviste, at størstedelen af atomets masse er koncentreret i en lille, positivt ladet kerne.
2. Atommodeludvikling:
* Thomsons Plum Pudding Model: Før Rutherfords eksperiment var den herskende model Thomsons blommepudding -model, hvor positiv ladning var ensartet fordelt over hele atomet med negativt ladede elektroner indlejret i. Rutherfords fund modbeviste denne model.
* Bohr Model: Senere forfinede Niels Bohr modellen til at omfatte elektroner, der kredser om kernen i specifikke energiniveauer.
3. Yderligere udvikling:
* Subatomære partikler: Yderligere eksperimenter opdagede eksistensen af protoner (positivt ladede) og neutroner (neutral) inden for kernen. Protoner og neutroner, samlet kendt som nukleoner, udgør størstedelen af en atoms masse.
Vigtig note:
* Mens kernen indeholder det meste af atomets masse, er det ikke * hele * messen. Elektroner, selv om de er meget lettere end protoner og neutroner, bidrager til atomets samlede masse.
* Kernen er utroligt tæt, og atomet er for det meste tomt rum. Dette koncept er vigtigt for at forstå, hvordan atomer interagerer med hinanden.
Sammenfattende leverede Rutherfords guldfolieeksperiment det oprindelige bevis for den koncentrerede masse i atomets kerne, som senere blev bekræftet af yderligere opdagelser og forbedringer til atommodellen.
Sidste artikelEn positivt ladet, hvad har flere protoner end elektroner?
Næste artikelEr god leder af varme en fysisk eller kemisk?
 Varme artikler
Varme artikler
-
 Banebrydende forskning gør børnevacciner sikre ved alle temperaturerAsel Sartbaeva fra University of Bath har ledet arbejdet. Kredit:University of Bath Vacciner er notorisk svære at transportere til fjerntliggende eller farlige steder, da de ødelægges, når de ikke
Banebrydende forskning gør børnevacciner sikre ved alle temperaturerAsel Sartbaeva fra University of Bath har ledet arbejdet. Kredit:University of Bath Vacciner er notorisk svære at transportere til fjerntliggende eller farlige steder, da de ødelægges, når de ikke -
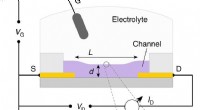 Ny metode benchmarks organiske blandede ledereOECT beskrivelse og betjening. et OECT -tværsnit, ledninger, og dimensioner:kanallængde (L), og tykkelse (d). Kilden, dræne, og port (S, D, G, henholdsvis), og relevante spændinger (gate, afløbsspændi
Ny metode benchmarks organiske blandede ledereOECT beskrivelse og betjening. et OECT -tværsnit, ledninger, og dimensioner:kanallængde (L), og tykkelse (d). Kilden, dræne, og port (S, D, G, henholdsvis), og relevante spændinger (gate, afløbsspændi -
 Den schweiziske hærkniv af røgskærmeEn ny type røggranat, der kan skjule sensorer i det synlige og infrarøde område, brænder under en test. Kredit:US Army At udløse røgbomber er mere end god fornøjelse den fjerde juli. Militæret bru
Den schweiziske hærkniv af røgskærmeEn ny type røggranat, der kan skjule sensorer i det synlige og infrarøde område, brænder under en test. Kredit:US Army At udløse røgbomber er mere end god fornøjelse den fjerde juli. Militæret bru -
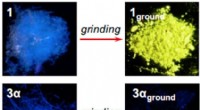 Guldforbindelse skifter fra en synlig fluorescens til at udsende infrarød, når den jordes9-anthryl guld(I) isocyanid (3α) bliver usynligt og udsender infrarødt efter det er malet, mens phenylguld(I) isocyanid (1) bliver gult. Kredit:Seki T. et al., Journal of the American Chemical Societ
Guldforbindelse skifter fra en synlig fluorescens til at udsende infrarød, når den jordes9-anthryl guld(I) isocyanid (3α) bliver usynligt og udsender infrarødt efter det er malet, mens phenylguld(I) isocyanid (1) bliver gult. Kredit:Seki T. et al., Journal of the American Chemical Societ
- Katastrofehjælp og psykologien bag begivenheder, der er en gang i livet
- Hvordan ville en måneformørkelse se ud, hvis du var astronaut, der stod på månen?
- Fotogenkendelse, der holder personlige interesser private
- Hvilken energi går ud af en mikrofon?
- Bevaringsøkologer opstiller et sæt retningslinjer for, hvordan udryddelse kan gøres mere økologi…
- Hvor gammel er tornadoen på Jupiter?


