Hvilke elektroner er vigtige for binding?
Her er hvorfor:
* Valenselektroner er yderste: De bor i det yderste energiniveau af et atom.
* De bestemmer reaktivitet: Antallet af valenselektroner dikterer, hvordan et atom interagerer med andre atomer.
* involveret i deling og overførsel: Valenselektroner er dem, der deles (i kovalente bindinger) eller overføres (i ioniske bindinger) for at danne kemiske bindinger.
Lad os nedbryde de typer obligationer:
* kovalente obligationer: Atomer deler valenselektroner for at opnå en stabil elektronkonfiguration (ligner normalt en ædel gas).
* ioniske bindinger: Et atom donerer valenselektroner til et andet atom, hvilket resulterer i en positivt ladet ion (kation) og en negativt ladet ion (anion). Den elektrostatiske tiltrækning mellem disse modsatte ladede ioner holder båndet sammen.
Eksempel:
Overvej elementets klor (CL). Det har 7 valenselektroner. For at opnå en stabil konfiguration har den brug for endnu en elektron. Det kan få dette elektron ved at danne en ionisk binding med natrium (NA), som har en valenselektron at give væk.
Key Takeaway: Mens alle elektroner i et atom bidrager til dets samlede opførsel, er det valenselektroner, der spiller hovedrollen i bestemmelsen af, hvordan atomer binder sammen.
Sidste artikelHvorfor har alkalimetal lav ioniseringsenergi?
Næste artikelFriktionen mellem bevægelige molekyler i en væske kaldes?
 Varme artikler
Varme artikler
-
 Forskere skaber morphing-krystaller drevet af vandfordampningForskere har udviklet tripeptidkrystaller (illustreret ovenfor), som har vandige porer, der udvider og trækker sig sammen som reaktion på fugtændringer og bruger fordampning til at skabe en effektiv m
Forskere skaber morphing-krystaller drevet af vandfordampningForskere har udviklet tripeptidkrystaller (illustreret ovenfor), som har vandige porer, der udvider og trækker sig sammen som reaktion på fugtændringer og bruger fordampning til at skabe en effektiv m -
 Nye værktøjer til undersøgelse af bioaktive lipiderKredit:CC0 Public Domain NAEer er bioaktive lipidmolekyler, der ser ud til at spille roller i energibalancen, betændelse, stressreaktioner og afhængighed. Hvordan NAE -niveauer reguleres og deres
Nye værktøjer til undersøgelse af bioaktive lipiderKredit:CC0 Public Domain NAEer er bioaktive lipidmolekyler, der ser ud til at spille roller i energibalancen, betændelse, stressreaktioner og afhængighed. Hvordan NAE -niveauer reguleres og deres -
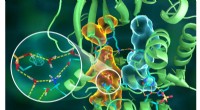 Neutroner maler atomportræt af prototypisk cellesignalingsenzymIllustration af den indviklede organisering af PKA -strukturen, hvor forskellige dele af proteinet er forbundet via udførlige hydrogenbindingsnetværk (stiplede gule linjer), limet sammen af de hydro
Neutroner maler atomportræt af prototypisk cellesignalingsenzymIllustration af den indviklede organisering af PKA -strukturen, hvor forskellige dele af proteinet er forbundet via udførlige hydrogenbindingsnetværk (stiplede gule linjer), limet sammen af de hydro -
 Et laserfokus på at finde bedre måder at lave vedvarende brændstoffer påJay Winkler og hans team zapper metaller for at skabe nye solenergi-brændstofkatalysatorer. Kredit:California Institute of Technology I jagten på alternativer til oliebaserede brændstoffer, en af
Et laserfokus på at finde bedre måder at lave vedvarende brændstoffer påJay Winkler og hans team zapper metaller for at skabe nye solenergi-brændstofkatalysatorer. Kredit:California Institute of Technology I jagten på alternativer til oliebaserede brændstoffer, en af


