Neutroner maler atomportræt af prototypisk cellesignalingsenzym
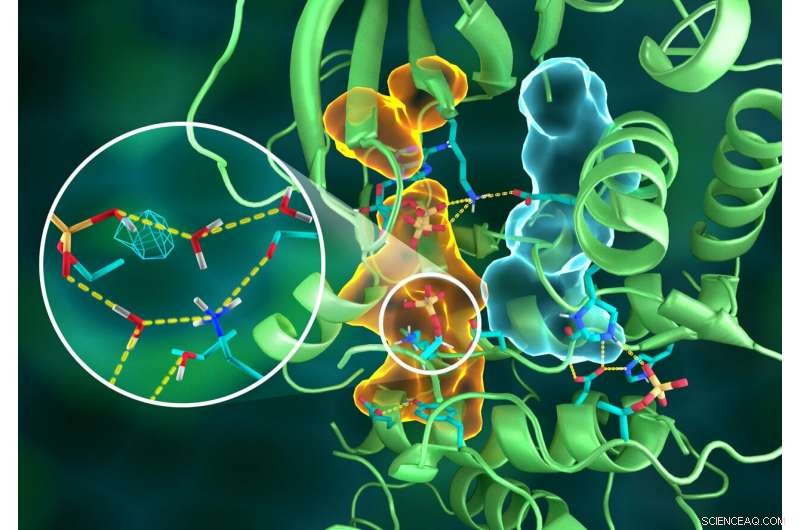
Illustration af den indviklede organisering af PKA -strukturen, hvor forskellige dele af proteinet er forbundet via udførlige hydrogenbindingsnetværk (stiplede gule linjer), limet sammen af de hydrofobe samlinger (lyseblå og orange mængder) - alle arbejder sammen om at bygge det funktionelle aktive sted. Indsæt viser protonation af den overførte phosphorylgruppe (cyan mesh) og dens mange interaktioner med vand og de aktive sted aminosyrerester. Kredit:ORNL/Jill Hemman
Direkte observationer af strukturen og den katalytiske mekanisme for et prototypisk kinaseenzym - proteinkinase A eller PKA - vil give forskere og lægemiddeludviklere betydeligt forbedrede evner til at forstå og behandle dødelige sygdomme og neurologiske lidelser som kræft, diabetes, og cystisk fibrose.
Opdagelsen blev foretaget af et internationalt team af forskere, der brugte makromolekylær neutronkrystallografi ved Department of Energy's Oak Ridge National Laboratory og Institut Laue-Langevin i Grenoble, Frankrig. Bygger på en årti lang undersøgelse, den samlede indsats afslørede tidligere ukendte egenskaber ved den arketypiske proteinkinase, herunder et komplet kort over atomstrukturen og grundlaget for enzymets kemi, der anvendes i cellulær signalering. Detaljerne offentliggøres i tidsskriftet Videnskab fremskridt .
Kinaser er en stor gruppe af hundredvis af enzymer, der er ansvarlige for at starte og regulere utallige cellulære processer. Kinaser sender signaler til proteiner ved hjælp af fosforylering - tilføjer en reaktiv kemisk gruppe bestående af fosfor og ilt til et bestemt sted på et substratprotein for at aktivere dets specifikke biologiske funktion.
Problemer opstår, når genmutationer får kinaser til at fungere forkert, hvilket igen fører til sygdom. En funktionssvigt kinase, eller en der ikke kan deaktiveres, kunne være ansvarlig for overekspression af proteiner, der fører til ukontrollabel formering af kræftceller. Det modsatte er også tilfældet ved neurologiske lidelser, hvor en funktionsfejlende kinase ganske enkelt får celler til at dø.
"Oprettelse af lægemidler, der er målrettet mod specifikke kinaser, er ekstremt vigtig, "sagde medforfatter Andrey Kovalevsky." Denne detaljerede forståelse af PKA-strukturen og dens dynamik vil fortælle os mere om andre former for kinaser og bør hjælpe lægemiddeludviklere med at designe nye lægemidler med bedre specificitet, som i sidste ende ville oversætte til mere præcise terapier med færre bivirkninger. "
Ændringer i proteinstrukturen på grund af mutationer kan være svære at opdage, selvom mutationernes virkninger på proteindynamisk adfærd kan være ret dybtgående. Imidlertid, disse dynamiske adfærd bliver mere tydelige ved at undersøge det samlede hydrogenbindingsnetværk i hele proteinet.
Neutroner er unikt følsomme over for lette elementer såsom brint. Fordi cirka 50 procent af alle atomer i proteiner er hydrogen, og de fleste af de kemiske reaktioner, som enzymer katalyserer, involverer hydrogen, neutroner er en ideel og uovertruffen probe til at detektere positionerne for hydrogenatomer i proteinstrukturen og spore deres bevægelse under katalyse.
Neutrondiffraktion ved hjælp af IMAGINE -diffraktometeret ved ORNL's High Flux Isotope Reactor, en DOE Office of Science brugerfacilitet, og LADI-III diffraktometer ved ILL gjorde det muligt for forskere at se de nøjagtige positioner af hydrogenatomer for at afsløre hele kinasestrukturen samt protonationstilstandene for alle aminosyrer i PKA og liganderne bundet til dets aktive sted, hvoraf mange tidligere var ukendte.
"Neutroner satte os i stand til at validere røntgenforudsigelser af hydrogenatomstillinger, samt bestemmelse af protonationstilstande for kemiske grupper, der ikke var kendt, eller på steder, hvor vi ikke havde forventet at finde dem. Dette store kemiske fremskridt baner vejen for mere sofistikerede molekylære modellerings- og simuleringsstudier af proteinkinasestruktur og funktion, "sagde den tilsvarende forfatter Susan Taylor.
"Neutroner giver et hidtil uset billede af hydrogenbindingsnetværket omkring og inden for det aktive sted for PKA og giver afgørende indsigt i, hvordan allosterisk transmission af information gennem proteinstrukturen sker, "tilføjede medforfatter Gianluigi Veglia." Kombination af neutronkrystallografi med nuklear magnetisk resonansspektroskopi vil give en omfattende forståelse af, hvordan enzymer fungerer. "
 Varme artikler
Varme artikler
-
 Oprindelsen af bismag i løgKredit:American Chemical Society At hakke løg er normalt forbundet med vandige og stikkende øjne. Men efter at løgene er skåret i tern og tårerne er tørret, grøntsagsstykkerne kan nogle gange udvi
Oprindelsen af bismag i løgKredit:American Chemical Society At hakke løg er normalt forbundet med vandige og stikkende øjne. Men efter at løgene er skåret i tern og tårerne er tørret, grøntsagsstykkerne kan nogle gange udvi -
 Katalysatorfremskridt kan føre til økonomiske brændselscellerSkematisk illustration af enkeltatomskatalysator forankret på porøst kulstof. Kredit:WSU Forskere ved Washington State University har udviklet en ny måde at lave billige, enkeltatoms katalysatorer
Katalysatorfremskridt kan føre til økonomiske brændselscellerSkematisk illustration af enkeltatomskatalysator forankret på porøst kulstof. Kredit:WSU Forskere ved Washington State University har udviklet en ny måde at lave billige, enkeltatoms katalysatorer -
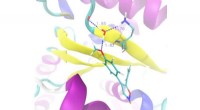 Forskere opdager nyt anti-cancer molekyleSnapshot fra simulering af molekylær dynamik af forbindelse 2c bundet til tubulin. Et system af hydrogenbindinger blev dannet, der involverer liganden, proteinresterne Asn349 og Lys352 og et vandmolek
Forskere opdager nyt anti-cancer molekyleSnapshot fra simulering af molekylær dynamik af forbindelse 2c bundet til tubulin. Et system af hydrogenbindinger blev dannet, der involverer liganden, proteinresterne Asn349 og Lys352 og et vandmolek -
 Kunstige celler-i-celler udløst af lys fungerer som mini-kemiske reaktorerCircles in a Circle af Kandinsky. Kredit:Philadelphia Museum of Art, Louise og Walter Arensbergs Samling, 1950-134-104 Kunstige celler, der frigiver materialer, når de udsættes for lys, er blevet
Kunstige celler-i-celler udløst af lys fungerer som mini-kemiske reaktorerCircles in a Circle af Kandinsky. Kredit:Philadelphia Museum of Art, Louise og Walter Arensbergs Samling, 1950-134-104 Kunstige celler, der frigiver materialer, når de udsættes for lys, er blevet
- Giver smarte køretøjer deres retningssans
- COVID-19:Farerne ved en lige nok, just in time madsystem
- Dollars og sans for store batterier på nettet
- Fremme i forståelsen af all-solid-state batterier
- Er blændet anmeldelse nok? Hvordan kønnede resultater opstår selv under anonym evaluering
- Begyndelsen af den sidste istid


