Hvorfor har alkalimetal lav ioniseringsenergi?
* stor atomradius: Alkalimetaller har en enkelt valenselektron i deres yderste skal, og dette elektron er relativt langt fra kernen på grund af deres store atomradier. Denne afstand svækker den elektrostatiske tiltrækning mellem kernen og valenselektronen, hvilket gør det lettere at fjerne.
* svag nuklearafgift: Den effektive atomafgift, som valenselektronen oplever, er lav. Dette skyldes, at de indre skalelektroner beskytter valenselektronen mod den fulde positive ladning af kernen. Jo svagere attraktion, jo lettere er det at fjerne elektronet.
* enkelt valenselektron: At have kun en valenselektron betyder, at den er mindre tæt holdt og oplever mindre elektronelektron-frastødning sammenlignet med elementer med flere valenselektroner.
Disse faktorer kombineres for at gøre alkalimetaller meget reaktive og danner let kationer ved at miste deres enkelt valenselektron.
Her er en simpel analogi:Forestil dig en ballon bundet til en streng. Jo længere ballonen er fra strengen, jo svagere kraft holder den. Tilsvarende er den yderligere valenselektron fra kernen (på grund af stor atomradius), jo svagere er attraktionen og lettere at fjerne.
Sidste artikelAngiv tre ting, som partikelmodellen siger om væske?
Næste artikelHvilke elektroner er vigtige for binding?
 Varme artikler
Varme artikler
-
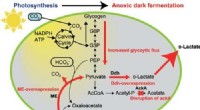 Metoden giver høj mængde af D-lactat ved hjælp af cyanobakterier, kunne revolutionere produktione…Figur 1:Vejen til omdannelse af kuldioxid til D-laktat. Synechocystis sp. PCC 6803 producerer glykogen inde i sine celler fra CO2 og lys. Det blev afsløret, at når Synechocystis sp. PCC 6803, der har
Metoden giver høj mængde af D-lactat ved hjælp af cyanobakterier, kunne revolutionere produktione…Figur 1:Vejen til omdannelse af kuldioxid til D-laktat. Synechocystis sp. PCC 6803 producerer glykogen inde i sine celler fra CO2 og lys. Det blev afsløret, at når Synechocystis sp. PCC 6803, der har -
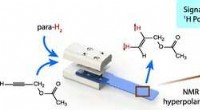 Nye lægemiddeltestforskninger kan drastisk reducere behovet for forsøgsdyrKredit:ACS Undersøgelser fra University of Southampton om en ny måde at teste lægemidler på kan væsentligt reducere behovet for forsøgsdyr. Professor Marcel Utz, Leder af magnetisk resonans ved u
Nye lægemiddeltestforskninger kan drastisk reducere behovet for forsøgsdyrKredit:ACS Undersøgelser fra University of Southampton om en ny måde at teste lægemidler på kan væsentligt reducere behovet for forsøgsdyr. Professor Marcel Utz, Leder af magnetisk resonans ved u -
 Meget selektivt adsorberende materiale tiltrækker uønskede materialer til gavn for biofremstillingEZ Select demonstrerer superhydrofobe egenskaber ved at afvise en dråbe vand. Kredit:Mary Kelly og Claire Kohout, Argonne National Laboratory En skummende stout, et solidt brød, en skarp ost; hver
Meget selektivt adsorberende materiale tiltrækker uønskede materialer til gavn for biofremstillingEZ Select demonstrerer superhydrofobe egenskaber ved at afvise en dråbe vand. Kredit:Mary Kelly og Claire Kohout, Argonne National Laboratory En skummende stout, et solidt brød, en skarp ost; hver -
 Forskere foreslår ny koblingsstrategi for organisk spildevandsrensningGrafisk abstrakt. Kredit:Anvendt katalyse B:Miljø (2022). DOI:10.1016/j.apcatb.2022.121858 En fælles forskergruppe ledet af prof. Sun Chenglin, prof. Wei Huangzhao og prof. Li Rengui fra Dalian Ins
Forskere foreslår ny koblingsstrategi for organisk spildevandsrensningGrafisk abstrakt. Kredit:Anvendt katalyse B:Miljø (2022). DOI:10.1016/j.apcatb.2022.121858 En fælles forskergruppe ledet af prof. Sun Chenglin, prof. Wei Huangzhao og prof. Li Rengui fra Dalian Ins
- Ruslands rumchef sparrer med Elon Musk om opsendelsespriser
- Game of drones:Lufthavne samler virksomheder for at bekæmpe truslen ovenfra
- Hvorfor er drikke dåser lavet af stål?
- Hvordan opbygges statisk elektricitet i skyer?
- Et stof, der kun komponerer af et type atom?
- Hvad får peberfrugter til at rødme


