Indeholdende element af atomnummer 53 i pentavalent tilstand?
hvorfor iod kan være pentavalent
* Elektronkonfiguration: Jod har den elektroniske konfiguration [KR] 4D¹⁰ 5S² 5P⁵. Det kan opnå en stabil oktet ved at få et elektron til dannelse af iodidion (I⁻). Det kan dog også miste elektroner til dannelse af positive oxidationstilstande.
* udvidet Octet: Jod, der er et stort atom, kan rumme mere end otte elektroner i sin valensskal. Dette gør det muligt for det at danne forbindelser, hvor det har en +5 oxidationstilstand.
Eksempler på jod i en pentavalent tilstand
* iodinsyre (hio₃): I denne forbindelse er jod i +5 oxidationstilstand.
* iodater: Salte indeholdende iodationen (IO₃⁻), såsom kaliumiodat (KIO₃), har også jod i +5 oxidationstilstand.
* jodpentafluorid (if₅): Denne forbindelse har jod med en +5 oxidationstilstand.
Bemærk: Mens jod kan opnå en pentavalent tilstand, er den mindre almindelig sammenlignet med dens lavere oxidationstilstande (-1, +1, +3, +7). Dette skyldes den stigende elektronegativitet af ilt, der har en tendens til at favorisere højere oxidationstilstande for jod.
Sidste artikelHvad er et eksempel på en væske?
Næste artikelBevægelsen af to stoffer fra de tilfældige molekyler kaldes?
 Varme artikler
Varme artikler
-
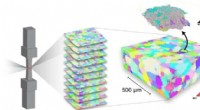 3D-eksperimenter kaster nyt lys over formhukommelseslegeringerUdviklingen af den interne mikrostruktur af en nikkel-titaniumprøve måles, mens den testes mekanisk. Farverne svarer til krystallografisk orientering, og orienteringerne er samlet i korn, eller krys
3D-eksperimenter kaster nyt lys over formhukommelseslegeringerUdviklingen af den interne mikrostruktur af en nikkel-titaniumprøve måles, mens den testes mekanisk. Farverne svarer til krystallografisk orientering, og orienteringerne er samlet i korn, eller krys -
 Forskere udvikler en metode til at teste fluorescerende biosensorer, før de syntetiseresEn illustration viser tøjringen, der forbinder et ArcLight-proteins fluorescerende domæne (grønt og gråt) til dets spændingsfølende domæne (orange) i en neurons membran. Risforskere foreslår i en ny u
Forskere udvikler en metode til at teste fluorescerende biosensorer, før de syntetiseresEn illustration viser tøjringen, der forbinder et ArcLight-proteins fluorescerende domæne (grønt og gråt) til dets spændingsfølende domæne (orange) i en neurons membran. Risforskere foreslår i en ny u -
 Skræddersyede enzymatiske løsninger reducerer tid og omkostninger ved bioraffinaderierKredit:MetGen Ikke mad, træagtige materialer (nemlig lignocelluloseholdig biomasse) er det største vedvarende reservoir af fermenterbar stivelse til erstatning for fossile brændstoffer. Det kan br
Skræddersyede enzymatiske løsninger reducerer tid og omkostninger ved bioraffinaderierKredit:MetGen Ikke mad, træagtige materialer (nemlig lignocelluloseholdig biomasse) er det største vedvarende reservoir af fermenterbar stivelse til erstatning for fossile brændstoffer. Det kan br -
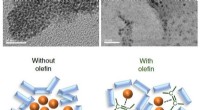 Forøgelse af kemiske reaktioner i fast tilstandØverst:Elektronmikroskopiske billeder af palladium -nanopartikler i reaktionsblandingerne. Efter 99 minutters reaktion, palladiumkatalysatoren blev fundet aggregeret og deaktiveret selv (til venstre),
Forøgelse af kemiske reaktioner i fast tilstandØverst:Elektronmikroskopiske billeder af palladium -nanopartikler i reaktionsblandingerne. Efter 99 minutters reaktion, palladiumkatalysatoren blev fundet aggregeret og deaktiveret selv (til venstre),
- Hvad har den største energitæthed pr. Volumen basis?
- Hvor vigtigt er at være at være videnskabsmand?
- Hvorfor styrter et NASA-rumfartøj ind i en asteroide?
- Forbedring af klimamodeller til at tage højde for planteadfærd giver gode nyheder
- Hvorfor er enzymer vigtige i en celle?
- Hvor mange gram natrium er i 0,820 mol Na2SO4?


