Hvorfor er elektronaffiniteten for clorine større end jod?
* størrelse: Klor er mindre end jod. Dette betyder, at den yderste elektron i klor er tættere på kernen og oplever en stærkere elektrostatisk attraktion. Denne stærkere attraktion gør det mere gunstigt for klor at få et elektron.
* Effektiv nuklearafgift: Chlor har en højere effektiv nuklear ladning (den nettopositive ladning, der opleves af valenselektronerne) end jod. Dette skyldes, at kerneelektroner i klor er bedre til at afskærme valenselektroner fra kernen sammenlignet med jod. Den højere effektive atomafgift i klor bidrager også til en stærkere attraktion for en indkommende elektron.
* Elektronelektronafvisninger: Når du bevæger dig ned ad den periodiske tabel, tilføjes elektronskaller, hvilket øger antallet af elektroner i et atom. Det øgede antal elektroner i jod fører til større elektronelektronafvisninger, hvilket gør det mindre gunstigt at tilføje en anden elektron.
Kortfattet:
* mindre størrelse og Højere effektiv nuklearafgift i klor fører til en stærkere attraktion for en elektron.
* øget elektronelektronafvisninger I jod gør det mindre gunstigt at få et elektron.
Denne kombination af faktorer resulterer i en højere elektronaffinitet for klor sammenlignet med jod.
Sidste artikelHar metaller en lav specifik varme?
Næste artikelNavngiv to metaller, der ikke leder elektricitet?
 Varme artikler
Varme artikler
-
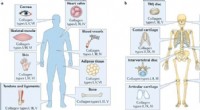 Forskere kvantificerer, karakterisere og identificere kollagens funktioner dens undertyperKredit:University of California, Irvine Fundet i brusk, knogler, blodårer, hud, og andre bindevæv, kollagener er de mest almindelige proteiner efter vægt i menneskekroppen. I en artikel, der for n
Forskere kvantificerer, karakterisere og identificere kollagens funktioner dens undertyperKredit:University of California, Irvine Fundet i brusk, knogler, blodårer, hud, og andre bindevæv, kollagener er de mest almindelige proteiner efter vægt i menneskekroppen. I en artikel, der for n -
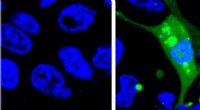 Ny, mere følsom sensor til vurdering af lægemiddelsikkerhedBillede af celler, der udtrykker AgHalo -sensoren før (venstre) og efter (højre) cellestress. AgHalo -sensoren tændes, når fejlfoldede proteiner begynder at aggregeres og giver et kvantitativt mål for
Ny, mere følsom sensor til vurdering af lægemiddelsikkerhedBillede af celler, der udtrykker AgHalo -sensoren før (venstre) og efter (højre) cellestress. AgHalo -sensoren tændes, når fejlfoldede proteiner begynder at aggregeres og giver et kvantitativt mål for -
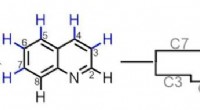 Kemikere opnår molekylær redigeringScripps Research og University of California, Los Angeles, har udviklet metoder til at modificere en bred klasse af kemiske forbindelser, der almindeligvis bruges til at bygge lægemiddelmolekyler. Bil
Kemikere opnår molekylær redigeringScripps Research og University of California, Los Angeles, har udviklet metoder til at modificere en bred klasse af kemiske forbindelser, der almindeligvis bruges til at bygge lægemiddelmolekyler. Bil -
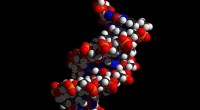 Oligomerer observerede at efterligne kombinationen af DNA-strengeKredit:CC0 Public Domain Et internationalt forskerhold har for første gang observeret dynamiske kovalente oligomerer, der efterligner kombinationen af komplementære DNA-strenge, hvilket kan føre
Oligomerer observerede at efterligne kombinationen af DNA-strengeKredit:CC0 Public Domain Et internationalt forskerhold har for første gang observeret dynamiske kovalente oligomerer, der efterligner kombinationen af komplementære DNA-strenge, hvilket kan føre


