Hvorfor er gas så let tæt?
Her er hvorfor:
* afstand: I gasser er molekylerne langt fra hinanden med meget tomt rum mellem dem. Dette betyder, at der er færre molekyler pakket i et givet volumen sammenlignet med faste stoffer og væsker.
* svage attraktioner: Kræfterne til tiltrækning mellem gasmolekyler er meget svage. Dette gør det muligt for molekylerne at bevæge sig frit og uafhængigt i stedet for at være tæt pakket sammen.
* kinetisk energi: Gasmolekyler har høj kinetisk energi, hvilket betyder, at de bevæger sig meget hurtigt og kolliderer ofte. Denne konstante bevægelse holder molekylerne spredt og forhindrer dem i at klumpe sammen.
I modsætning:
* faste stoffer: Molekyler i faste stoffer er tæt pakket og har stærke attraktioner, hvilket resulterer i høj densitet.
* væsker: Molekyler i væsker er tættere sammen end i gasser, men har svagere attraktioner end i faste stoffer. De har en højere densitet end gasser, men lavere tæthed end faste stoffer.
Denne forskel i densitet er grunden til, at gasser er mindre tætte end faste stoffer og væsker. Den store afstand mellem molekyler i gasser betyder, at der er mere tom plads, hvilket gør dem mindre tætte.
Sidste artikelHvad har flere molekyler 1 liter vand eller is?
Næste artikelEr inde i ballonens fast væske eller en gas?
 Varme artikler
Varme artikler
-
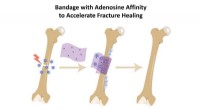 Knoglebandage opsuger pro-helende biokemiske for at fremskynde reparationenEn ny type knoglebandage fanger naturligt produceret adenosin tæt på bruddet, som fremmer og fremskynder helingen på stedet, før den langsomt frigiver adenosinen tilbage i kroppen. Kredit:Shyni Varghe
Knoglebandage opsuger pro-helende biokemiske for at fremskynde reparationenEn ny type knoglebandage fanger naturligt produceret adenosin tæt på bruddet, som fremmer og fremskynder helingen på stedet, før den langsomt frigiver adenosinen tilbage i kroppen. Kredit:Shyni Varghe -
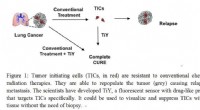 Alsidig sensor mod tumorinitierende cellerDe fleste kræftdødsfald skyldes tilbagevendende eller metastatiske tumorer. Konventionelle terapier er målrettet mod hurtigt delende tumorceller, men er ude af stand til at udrydde de stærkt kemoresis
Alsidig sensor mod tumorinitierende cellerDe fleste kræftdødsfald skyldes tilbagevendende eller metastatiske tumorer. Konventionelle terapier er målrettet mod hurtigt delende tumorceller, men er ude af stand til at udrydde de stærkt kemoresis -
 Selvkørende, endeløst programmerbare kunstige ciliaKredit:Harvard University I årevis har forskere forsøgt at konstruere små, kunstige cilia til miniature robotsystemer, der kan udføre komplekse bevægelser, herunder bøjning, vridning og vending. At
Selvkørende, endeløst programmerbare kunstige ciliaKredit:Harvard University I årevis har forskere forsøgt at konstruere små, kunstige cilia til miniature robotsystemer, der kan udføre komplekse bevægelser, herunder bøjning, vridning og vending. At -
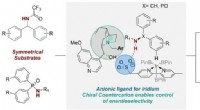 Metalkatalyserede reaktioner gjort enantioselektive ved brug af chiral kationKredit:University of Cambridge Forskere her har fundet frem til en strategi for at gøre en overgangsmetalkatalyseret kemisk reaktion enantioselektiv ved brug af en chiral kation. Arbejdet blev udf
Metalkatalyserede reaktioner gjort enantioselektive ved brug af chiral kationKredit:University of Cambridge Forskere her har fundet frem til en strategi for at gøre en overgangsmetalkatalyseret kemisk reaktion enantioselektiv ved brug af en chiral kation. Arbejdet blev udf
- Hvad er værdierne repræsenterer antal carbonatomer i en molmetan?
- I hvilket omfang forurener farmaceutiske og ulovlige stoffer byfloderne?
- Hvorfor kan mekaniske bølger rejse gennem et medium?
- Kaos er ikke tilfældighed:En kompleks systemforsker forklarer
- Hvordan cykler nitrogen gennem økosystemet?
- Cheerleaders hjælper med at opdage bakterier, der vokser bedre i nul-tyngdekraft


