Kan du bruge partikelteorien til at forklare, hvorfor et fast stof er tættere end gas?
Partikelteori Basics
* faste stoffer: Partikler i et fast stof er tæt pakket og arrangeret i et regelmæssigt, gentagne mønster. De har stærke tiltrækningskræfter, der holder dem sammen, hvilket kun tillader begrænset vibration.
* Gasser: Partikler i en gas er bredt fordelt og bevæger sig frit og tilfældigt. Kræfterne til tiltrækning mellem gaspartikler er svage.
densitet og partikelarrangement
* densitet defineres som masse pr. Enhedsvolumen (masse/volumen).
* faste stoffer: På grund af deres stramme pakning er partikler i et fast stof meget tættere sammen end i en gas. Dette betyder, at du kan passe meget mere masse ind i et givet volumen i et fast stof sammenlignet med en gas.
* Gasser: Den brede afstand mellem gaspartikler betyder, at der er meget tom plads inden for et volumen af gas. Dette resulterer i en lavere masse pr. Enhedsvolumen.
i enklere termer:
Forestil dig en kasse fyldt med kugler (der repræsenterer faste partikler). Forestil dig nu en kasse med samme størrelse fyldt med ping pong -kugler (der repræsenterer gaspartikler). Marmorerne vil være meget mere tæt pakket, hvilket gør kassen med kugler, der er tættere end kassen med ping pong -kugler.
Derfor fører den strammere pakning af partikler i et fast stof sammenlignet med en gas på grund af stærkere intermolekylære kræfter til en meget højere densitet for faste stoffer.
Sidste artikelHvad er eksempler på flydende metaller?
Næste artikelHvad hedder metoden, hvormed varme bevæger sig gennem en væske og gas?
 Varme artikler
Varme artikler
-
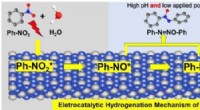 Hydrogeneringsregulering af nitrobenzen i elektrokatalytiske processer realiseretGrafisk abstrakt. En omfattende forståelse af selektiviteten over for elektrokatalytiske hydrogeneringsprodukter af nitrobenzen blev udført eksperimentelt og teoretisk over en Cu3Pt/C -legeringskataly
Hydrogeneringsregulering af nitrobenzen i elektrokatalytiske processer realiseretGrafisk abstrakt. En omfattende forståelse af selektiviteten over for elektrokatalytiske hydrogeneringsprodukter af nitrobenzen blev udført eksperimentelt og teoretisk over en Cu3Pt/C -legeringskataly -
 Nye automatiserede biologiske prøveanalysesystemer til at fremskynde sygdomsopdagelseIllustration af de anvendte matematiske transformationer, først på billedet af et skakbræt, derefter på mikrofluidiske multipoler. Kredit:Polytechnique Montréal og McGill University Professor Thom
Nye automatiserede biologiske prøveanalysesystemer til at fremskynde sygdomsopdagelseIllustration af de anvendte matematiske transformationer, først på billedet af et skakbræt, derefter på mikrofluidiske multipoler. Kredit:Polytechnique Montréal og McGill University Professor Thom -
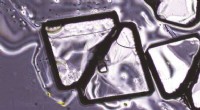 Fælles lægemiddelkilde til indsigt i dannelsen af sommerfuglekrystallerKredit:Australian Nuclear Science and Technology Organisation (ANSTO) Eksperimenter ved ANSTOs australske center for neutronspredning og den australske synkrotron har afsløret vækstmekanismen bag
Fælles lægemiddelkilde til indsigt i dannelsen af sommerfuglekrystallerKredit:Australian Nuclear Science and Technology Organisation (ANSTO) Eksperimenter ved ANSTOs australske center for neutronspredning og den australske synkrotron har afsløret vækstmekanismen bag -
 Et strejf af guld sender krystaller elektriske af spændingAtomisk model af en Au-SrTiO 3 Schottky interface. Kredit:University of Warwick Et strejf af guld - eller et andet ædelmetal - kan ændre strukturen af en krystal og dens iboende egenskaber, fy
Et strejf af guld sender krystaller elektriske af spændingAtomisk model af en Au-SrTiO 3 Schottky interface. Kredit:University of Warwick Et strejf af guld - eller et andet ædelmetal - kan ændre strukturen af en krystal og dens iboende egenskaber, fy
- Hvad er quantum weirdness?
- Hvad er 24 grader celsius lig med i grader?
- Hvor kommer den lysafhængige fra?
- Søger efter supernova neutrinoer med Deep Underground Neutrino Experiment
- Undersøgelse kunne skabe strategier til at øge det gode kolesterol
- Overfladetemperaturen på en stjerne er indikeret af hvilken fysisk egenskab?


