Har Lewis -strukturen SO2 resonansstruktur?
* Svovlens binding: Svovl kan udvide sin oktet, hvilket betyder, at den kan have mere end 8 elektroner i sin valensskal. Dette giver det mulighed for at danne mere end fire obligationer.
* placering af dobbelt obligation: I Lewis -strukturen af SO2 har du en dobbeltbinding og en enkelt binding mellem svovl og ilt. Imidlertid kan dobbeltbindingen faktisk placeres på enten iltatom.
Her er hvordan man repræsenterer resonansstrukturer:
1. Struktur 1: Dobbeltbindingen er mellem svovl og ilt til venstre.
2. struktur 2: Dobbeltbindingen er mellem svovl og ilt til højre.
Begge strukturer bidrager lige til den faktiske struktur af SO2, som er en hybrid af de to resonansformer. Dette betyder, at bindingerne mellem svovl og hvert ilt ikke er enkelt- eller dobbeltbindinger, men noget derimellem, med delvis dobbeltbindingskarakter.
Nøglepunkt: Resonansstrukturer er ikke forskellige molekyler, men snarere forskellige måder at repræsentere det samme molekyle på. De hjælper os med at forstå delokaliseringen af elektroner og den faktiske fordeling af elektrondensitet inden for molekylet.
 Varme artikler
Varme artikler
-
 Fødevarekvalitetskontrol blev gjort hurtigere og lettereBaseret på ultrahøjtydende væskekromatografi-massespektrometri (UHPLC-MS) har videnskabsfolk ved det tekniske universitet i München (TUM) og Leibniz-instituttet for fødevarebiologi udviklet en ny meto
Fødevarekvalitetskontrol blev gjort hurtigere og lettereBaseret på ultrahøjtydende væskekromatografi-massespektrometri (UHPLC-MS) har videnskabsfolk ved det tekniske universitet i München (TUM) og Leibniz-instituttet for fødevarebiologi udviklet en ny meto -
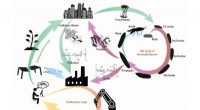 Team udvikler manglende led til cirkulær økonomi, mens de tackler globalt affaldSkematisk over det udviklede lukkede produktionskredsløb baseret på bioinspirerede kitinholdige materialer og biokonvertering i et bymiljø. Kredit:SUTD Forskere fra Singapore University of Technol
Team udvikler manglende led til cirkulær økonomi, mens de tackler globalt affaldSkematisk over det udviklede lukkede produktionskredsløb baseret på bioinspirerede kitinholdige materialer og biokonvertering i et bymiljø. Kredit:SUTD Forskere fra Singapore University of Technol -
 Superladede biomakromolekyler kan opretholde deres omordnede strukturer induceret, for eksempel, ved…Kredit:Wiley Stimuli-følsomme materialer kan reagere på fysiske kræfter med strukturelle faseovergange. Dette gælder også for blandinger af biopolymer og overfladeaktive stoffer, en undersøgelse f
Superladede biomakromolekyler kan opretholde deres omordnede strukturer induceret, for eksempel, ved…Kredit:Wiley Stimuli-følsomme materialer kan reagere på fysiske kræfter med strukturelle faseovergange. Dette gælder også for blandinger af biopolymer og overfladeaktive stoffer, en undersøgelse f -
 Russiske videnskabsmænd udviklede en sensor til at detektere giftige stoffer i vandområderKredit:pixabay SUSU-forskere, med deres kolleger fra Belgien og Egypten, har udviklet og testet en sensor til miljøovervågning. Enheden afslører insekticider i vand. Forskningsresultaterne er offe
Russiske videnskabsmænd udviklede en sensor til at detektere giftige stoffer i vandområderKredit:pixabay SUSU-forskere, med deres kolleger fra Belgien og Egypten, har udviklet og testet en sensor til miljøovervågning. Enheden afslører insekticider i vand. Forskningsresultaterne er offe


