Har alle væsker en sammenhængende kraft?
sammenhængende kraft henviser til den attraktive kraft mellem molekyler af det samme stof. I væsker er disse kræfter svagere end i faste stoffer, men stærkere end i gasser.
Her er hvorfor:
* flydende molekyler er tæt på hinanden: Molekylerne i en væske er i konstant bevægelse, men er stadig relativt tæt sammen. Denne nærhed gør det muligt for attraktive kræfter at handle mellem dem.
* Intermolekylære kræfter: Disse kræfter, såsom hydrogenbinding, dipol-dipol-interaktioner og London-spredningskræfter, er ansvarlige for samhørighed i væsker. Styrken af disse kræfter varierer afhængigt af væsketypen.
* overfladespænding: Sammenhængende kræfter er ansvarlige for fænomenet overfladespænding, hvor overfladen af en flydende virker som en strakt membran. Dette skyldes det indre træk af sammenhængende kræfter på overflademolekylerne.
Eksempler:
* Vandmolekyler er meget sammenhængende på grund af stærk brintbinding.
* Kviksølvmolekyler har stærk metallisk binding, hvilket fører til høje sammenhængende kræfter.
* Olier har svagere sammenhængende kræfter sammenlignet med vand, hvilket resulterer i lavere overfladespænding.
Mens alle væsker har sammenhængende kræfter, varierer deres styrke meget. De specifikke egenskaber ved en væske, ligesom dens viskositet og kogepunkt, påvirkes direkte af styrken af dens sammenhængende kræfter.
Sidste artikelEr en gaffelleder eller isolator af varme?
Næste artikelHvilken proces ændrer vand fra væske til en gas?
 Varme artikler
Varme artikler
-
 Søger uorden som en katalysator for forandringDr. Rosalie Hocking skinner lys på uordnede mineraler for at finde katalysatorer, der kan gøre vand til rent brændstof. Kredit:Swinburne University of Technology Grønne kemikere drømmer om at repl
Søger uorden som en katalysator for forandringDr. Rosalie Hocking skinner lys på uordnede mineraler for at finde katalysatorer, der kan gøre vand til rent brændstof. Kredit:Swinburne University of Technology Grønne kemikere drømmer om at repl -
 Selvsteriliserende mikronåle udvikles i Australien til sikrere vaccinationerKredit:CC0 Public Domain Forskere ved University of South Australia har udviklet et mikronåleplaster med antibakterielle egenskaber for at gøre vaccinationer meget sikrere end traditionelle nåle e
Selvsteriliserende mikronåle udvikles i Australien til sikrere vaccinationerKredit:CC0 Public Domain Forskere ved University of South Australia har udviklet et mikronåleplaster med antibakterielle egenskaber for at gøre vaccinationer meget sikrere end traditionelle nåle e -
 Karbonatstandarder sikrer bedre paleotermometreEn ny undersøgelse af Bernasconi et al. beskriver en samfundsindsats-InterCarb-for at standardisere den kemiske analyse kendt som carbonatklumpet-isotoptermometri, ved hjælp af fælles karbonatstandard
Karbonatstandarder sikrer bedre paleotermometreEn ny undersøgelse af Bernasconi et al. beskriver en samfundsindsats-InterCarb-for at standardisere den kemiske analyse kendt som carbonatklumpet-isotoptermometri, ved hjælp af fælles karbonatstandard -
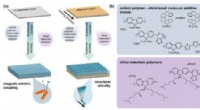 Et gennembrud inden for forskning i chiral polymer tyndfilm kunne muliggøre en ny generation af enh…Oprindelsen af de kirotiske effekter udforsket i dette værk. (a) en tegneserie, der skildrer de mekanismer, der understøtter den kirotiske reaktion i ikke-opstillede og justerede tynde film, og (b)
Et gennembrud inden for forskning i chiral polymer tyndfilm kunne muliggøre en ny generation af enh…Oprindelsen af de kirotiske effekter udforsket i dette værk. (a) en tegneserie, der skildrer de mekanismer, der understøtter den kirotiske reaktion i ikke-opstillede og justerede tynde film, og (b)
- Er fraværende brugere blindside arkitekter?
- Hvad beskriver videnskabelige love?
- Forskere på vej til at bygge en kraftfuld og praktisk kvantecomputer
- Er ungdomsfodbolden forbi sin bedste alder?
- Amazon-magnaten Bezos flyver ind i en internethandelsstorm i Indien
- Hvad er funktionen af slim i både luftveje og mave-tarmkanalen?


