Søger uorden som en katalysator for forandring

Dr. Rosalie Hocking skinner lys på uordnede mineraler for at finde katalysatorer, der kan gøre vand til rent brændstof. Kredit:Swinburne University of Technology
Grønne kemikere drømmer om at replikere fotosyntesens reaktioner. Af de mulige resultater, en af de mest omtalte er evnen til at lave billige brintbrændstoffer fra vand. I teorien, det eneste biprodukt ved forbrænding af brint er vand. Men lige nu er det meste brint enten udvundet af fossile brændstoffer eller lavet ved hjælp af energikrævende processer drevet af fossile brændstoffer.
Imidlertid, hvis videnskabsmænd som Swinburnes Dr. Rosalie Hocking kunne finde en måde at lave brint på på samme måde som de trin planter tager under fotosyntesen, mange af vores problemer med emissioner af fossile brændstoffer kan fordampe.
For at skabe sukker til eget brug, planter optager kuldioxid fra atmosfæren og suger vand op gennem deres rødder. I bladenes choroplaster, par af vandmolekyler splittes i to brintmolekyler og et iltmolekyle (se side 32). Molekylerne gør kun dette med et input af energi. I planter, klorofyler med manganklynger og forskellige enzymer tjener som fotokatalysatorer for at fremskynde reaktionen, alt sammen inden for et proteinkompleks kendt som fotosystem II. Planter forsynes derefter med deres grundenergienhed, når brint reagerer med CO 2 at danne glukose i et andet sæt reaktioner. Selv med sollys, imidlertid, disse reaktioner er langsomme.
Det er den første og sværeste del af ligningen - reaktionen, der splitter vand i brint og oxygen - der fascinerer Hocking, en lektor ved Swinburne, og modtageren af en vicekansler Kvinder i STEM Fellowship. Hun leder efter et stof, der kan fungere som en klorofyl-lignende katalysator for at fremskynde vandspaltningsreaktioner. Men da hendes team ser på krystallstrukturerne af mulige katalysatorer, et par mærkelige, uegnet mineraler er kommet i fokus.
Manganlignende uegnethed
I 2011 Hockings data fra en røntgenspektroskopi-strålelinje ved den australske synkrotron i Melbourne, viste noget slående om et mineral kaldet Birnessit (manganoxid). Mineralet, det viste sig, har tydelige ligheder i katalytisk reaktivitet med manganet i fotosystem II. Robust, billig og rigelig, Hocking og hendes samarbejdspartnere konkluderede, at denne Birnessite potentielt kunne hjælpe med at spalte vand, hvis den stimuleres af elektricitet.
"Rent faktisk, folk vidste længe, at Birnessite lignede dele af fotosystem II, " siger Hocking. "Men, tidligt, de testede en stabil version af dette materiale, fandt ud af, at den var 'død' med hensyn til katalytisk aktivitet og gik derefter videre."
Hun mener, at der har gemt sig mange nyttige katalysatorer på denne måde. "Når du laver et manganoxid i et kemilaboratorium, du kan bruge et ret rent system i destilleret vand, " forklarer hun. "Men når disse faser er lavet i naturen, der er kalk omkring, kalium, natrium, lidt jern. Det er rodet, og det er rodet, der ændrer reaktionsevnen.
"Meget af vores forskning har vist, at hvis man stabiliserer et system, du reducerer reaktiviteten og gør den mindre i stand til at udføre katalyse-forretningen - den er termodynamisk glad og ønsker ikke at acceptere eller frigive elektroner."
Birnessite er blandt en håndfuld andre metaloxider, der er fundet i stand til at spalte vand, herunder rutheniumoxid, iridiumoxid og koboltoxid.
En undersøgelse fra 2015 af forskere ved Florida State University og University of California, Berkeley, viste en måde at lægge Birnessite på for effektivt at opfange solenergi for at spalte vand.
En af forskerne involveret i denne undersøgelse foreslog, at fremtidige tage kan være dækket af dette mineral, og at det kunne gøre regnvand til energi ved hjælp af solen.
Men at indse denne forudsigelse er langt væk. Katalysatorer, der er nyttige til kunstig fotosyntese, er stadig lidt forståede og kræver ofte meget høje temperaturer for at virke. Hocking siger, for eksempel, at hvis de klassiske katalysatorer ville virke på den måde fotosyntese gør, hun tror, vi ville have set det allerede. "Hvis man ser på en masse industrielle katalysatorer, de har en tendens til at katalysere reaktioner, der ikke involverer nær så meget energi, " forklarer hun. "Mekanismerne i disse typer katalysatorer skal være fundamentalt forskellige."
Bevarende lysstråler
Katalysatorer er blandt Hockings specialiteter. Uddannet som røntgenspektroskopist ved Stanford University i USA, hun bruger en form for lys kendt som synkrotronstråling til at forstå materialer.
Lyset fra synkrotronstrålelinjer, genereret ved at accelerere elektroner til næsten lysets hastighed i faciliteter på størrelse med fodboldbaner, afslører røntgenstrukturdata, som er umulige at observere på anden måde. "Folk ringer ofte til mig for at sige, at de har en fantastisk ny katalysator, men de har brug for hjælp til at studere dens struktur, fordi de ikke ved, hvordan man bruger beamline, " siger Hocking.
"At være røntgenspektroskop giver mig den fordel, at jeg kan se masser af andre forskeres materialer. Og jeg vil altid lægge mærke til fællestræk og forskelle mellem dem."
Hocking mener, at videnskaben kan have overset katalysatorer som Birnessite, fordi deres struktur er for rodet til de fleste kemikeres smag. Hun siger, at kemikere tidligt er uddannet til at søge orden i molekyler for bedre at forstå dem, og så de har en indbygget skævhed mod ordnede krystallinske versioner af mineraler.
"Tænk på en førsteårs kemi lærebog, " siger Hocking. "Vi lærer eleverne om radius af ioner og atomer, og det kommer direkte fra røntgenkrystallografi, en analytisk teknik, der kun kan anvendes på materialer, der er helt bestilt. Disse begreber ligger til grund for nogle af vores allerførste antagelser som kemikere. "Ifølge Hocking, kemikere er rigtig gode til at karakterisere faste stoffer, der er krystallinske og er ret gode med molekylære systemer i opløsning, "men vi er forfærdelige til alt derimellem! Og ved at gøre det har vi ignoreret en masse ting."
Et andet potentielt meget rodet mineral er jernsulfid, som findes i svovl, der kommer fra miljøer med lavt iltindhold, såsom sumpvand. Jernsulfiders udbredelse i udenjordiske objekter har ført til forslag om, at det også kan være forbundet med den allerførste blomstring af liv på Jorden, og dermed den tidlige udvikling af fotosyntesen. Jernsulfider hjælper også med at regulere metaboliske processer i levende systemer ved at acceptere eller frigive elektroner.
På trods af deres enkle sammensætning af jern- og svovlatomer, jernsulfider kan antage et overraskende antal forskellige strukturer, men kan også være faldet i en kemisk blind vinkel. "Jernsulfidfaser er blevet overset, fordi videnskabsmænd kiggede på deres meget stabile former i stedet for deres naturlige tilstande, som er ekstremt uordnede med mange urenheder. Med jernsulfider, der genopdages som funktionelle elektrokatalysatormaterialer, det er rimeligt at spørge 'Hvad gik vi glip af for årtier siden?'"
Hockings seneste arbejde har fokuseret på 'metastabile' former for mangan og jernsulfider. Disse materialer omdannes til en anden tilstand over tid. Hendes Swinburne-laboratorium forsøger at tilpasse metastabile jernsulfider til at blive mere uordnede ved hjælp af tricks som hurtig nedbør, eller ved tilsætning af sæbevandede overfladeaktive stoffer, der forstyrrer krystaldannelse. "Det er nemt at gøre tingene ikke-krystallinske, " Hocking jokes. "Du skal bare prøve at vende det, du er blevet uddannet til at gøre som kemiker hele dit liv".
Store maskiner og mere
Det kan være langsomt at forstå disse nye forbindelser ved hjælp af det enorme maskineri ved synkrotronen. "De tager lang tid at sætte op, og det er svært at få din elektrokemi og spektroskopi rigtigt på samme tid, " siger Hocking. Holdet får måske kun tre eller fire dage om året til at køre afgørende tests. "Min rekord for at blive oppe er mere, end jeg burde indrømme, 48 timer eller deromkring."
Det, der øger vanskeligheden, er det faktum, at de karakteristiske 'forstyrrede' forbindelser er meget ekstra arbejde. For en krystallinsk orden, forskere kan lede efter en gruppe atomer, kendt som en enhedscelle, som kan gengive hele krystalstrukturen, når den gentages i tre dimensioner. For mere uordnede materialer virker disse eksperimenter bare ikke. Ofte beskrives materialerne som amorfe, hvilket betyder, at de ikke har nogen enhedscelle, så de kan ikke analyseres på konventionelle måder.
"Det er her synkrotronbaseret røntgenabsorptionsspektroskopi kan være ret nyttig, "forklarer Hocking." Vi kan bruge højenergilyset til at komme ind på metaldelene i en prøve og forstå nanostrukturen i den region. I vores gruppe, vi kombinerer røntgenspektroskopi med elektronmikroskopi for at forstå lidelse."
Hocking og hendes samarbejdspartner, Dr. Alexandr Simonov ved Monash University, har også brugt de sidste fem år på at udvikle en enhed, kaldet en in situ elektrokemisk celle, at måle en potentiel katalysators struktur og respons på elektrisk potentiale samtidigt. Holdet kan bruge det til at forbinde et materiales atomare ramme med det antal gange, en katalysator udfører en reaktion, før den bliver inaktiveret.
Det har allerede givet resultater. "There are some surprising differences in materials that we hadn't noticed, " says Hocking. "We are also able to see whole material responses, changes in its structure, or oxidation state, rather than just the active sites that people usually focus on in catalysis."
She hopes that using this new technology on overlooked disordered minerals will speed up the process of identifying many game-changing results. "I'm not a terribly tidy woman, " she adds, "and my group joke about me being interested in disordered materials when I'm a little disordered myself." But if she finds the key to splitting water, Hocking's finding will be far from a joke.
 Varme artikler
Varme artikler
-
 Nul til helten:Overset materiale kan hjælpe med at reducere vores CO2-fodaftrykKredit:Unsplash/CC0 Public Domain Det er nu velkendt, at kuldioxid er den største bidragyder til klimaændringer og stammer primært fra afbrænding af fossile brændstoffer. Mens der er igangværende
Nul til helten:Overset materiale kan hjælpe med at reducere vores CO2-fodaftrykKredit:Unsplash/CC0 Public Domain Det er nu velkendt, at kuldioxid er den største bidragyder til klimaændringer og stammer primært fra afbrænding af fossile brændstoffer. Mens der er igangværende -
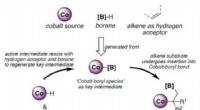 En omkostningseffektiv metode til at syntetisere kemiske byggestenFigur 1:Skematisk, der viser den foreslåede katalytiske vej til syntesen af geminale organodiborforbindelser. Kredit:National University of Singapore NUS-kemikere har udviklet en omkostningseffe
En omkostningseffektiv metode til at syntetisere kemiske byggestenFigur 1:Skematisk, der viser den foreslåede katalytiske vej til syntesen af geminale organodiborforbindelser. Kredit:National University of Singapore NUS-kemikere har udviklet en omkostningseffe -
 Små broer hjælper partikler med at holde sammenKredit:CC0 Public Domain Det sker uden for dit vindue, hver gang det regner:Jorden bliver våd og kan danne klistret mudder. Så tørrer det. Senere kan det regne igen. Hver befugtning og genfugtning
Små broer hjælper partikler med at holde sammenKredit:CC0 Public Domain Det sker uden for dit vindue, hver gang det regner:Jorden bliver våd og kan danne klistret mudder. Så tørrer det. Senere kan det regne igen. Hver befugtning og genfugtning -
 Sådan beregnes KfHvis du nogensinde har lavet is med en gammeldags churn, har du set frysepunktdepression - betegnet Tf - i aktion. Frysepunktdepression er tilsætningen af et opløst stof for at sænke frysepunktet
Sådan beregnes KfHvis du nogensinde har lavet is med en gammeldags churn, har du set frysepunktdepression - betegnet Tf - i aktion. Frysepunktdepression er tilsætningen af et opløst stof for at sænke frysepunktet
- Det utrolige krympende kredsløb
- Brint fra naturgas uden kuldioxidudledning
- Forskere afslører, hvordan celler interagerer med støttende proteiner for at hele sår
- Miniaturiserede robotter kan drives gennem biologiske væsker ved en enzymatisk reaktion eller ultra…
- Stardust kører oftere på meteoritter end tidligere antaget
- Undersøgelse afslører høj forholdskvalitet i par af samme køn


