Hvad opdagede Ernest Rutherford om strukturen af et atom?
* Atomet har en tæt, positivt ladet kerne i centrum. Dette var i modsætning til den herskende "blommepudding -model", som antydede, at den positive ladning blev jævnt fordelt over hele atomet. Rutherford observerede, at de fleste alfapartikler passerede lige gennem guldfolien, men nogle blev afbøjet i store vinkler, og et par endda sprang tilbage. Dette antydede, at den positive ladning var koncentreret i en lille, tæt region, som han navngav kernen.
* Det meste af atomet er tomt rum. Da de fleste alfa -partikler passerede gennem folien uden at blive afbøjet, konkluderede Rutherford, at atomet for det meste var tomt rum, med elektroner, der kredsede om kernen.
Denne opdagelse revolutionerede vores forståelse af atomet og førte til udviklingen af planetmodellen for atomet , der afbildede elektroner, der kredser om kernen som planeter, der kredser om solen.
Mens Rutherfords model var en betydelig forbedring i forhold til tidligere modeller, blev den senere forfinet af Niels Bohr, der introducerede konceptet med kvantiserede energiniveau for elektroner.
Sidste artikelHvem opfandt nuklearatom?
Næste artikelHvad sker der tætheden af en gas, da den er komprimeret?
 Varme artikler
Varme artikler
-
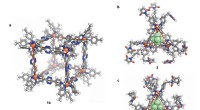 Kovalent post-montage modifikationskaskade af selvsamlede supramolekylære strukturerAfbildninger (samme skala) af røntgenkrystalstrukturerne. en, Terning 1b. b, PF6 − addukt af tetraeder 3. c, AsF6 - addukt af modificeret tetraeder 4a. Atomfarver:grå, C; hvid, H; rød, O; blå, N; oran
Kovalent post-montage modifikationskaskade af selvsamlede supramolekylære strukturerAfbildninger (samme skala) af røntgenkrystalstrukturerne. en, Terning 1b. b, PF6 − addukt af tetraeder 3. c, AsF6 - addukt af modificeret tetraeder 4a. Atomfarver:grå, C; hvid, H; rød, O; blå, N; oran -
 Maling med halvlederePerovskite portræt af Marie Skłodowska-Curie. Kredit:Lukas Helmbrecht AMOLF-forskerne Lukas Helmbrecht og Wim Noorduin har udviklet en reaktiv blæk, der kan males på et lige så reaktivt lærred. Bl
Maling med halvlederePerovskite portræt af Marie Skłodowska-Curie. Kredit:Lukas Helmbrecht AMOLF-forskerne Lukas Helmbrecht og Wim Noorduin har udviklet en reaktiv blæk, der kan males på et lige så reaktivt lærred. Bl -
 Undersøgelse af opvarmede tobaksprodukterKredit:Pixabay/CC0 Public Domain En ny artikel, der undersøger, om opvarmede tobaksprodukter udsender røg, er blevet offentliggjort i det akademiske tidsskrift American Chemical Society Omega . Pr
Undersøgelse af opvarmede tobaksprodukterKredit:Pixabay/CC0 Public Domain En ny artikel, der undersøger, om opvarmede tobaksprodukter udsender røg, er blevet offentliggjort i det akademiske tidsskrift American Chemical Society Omega . Pr -
 Takket være maskinlæring, fremtiden for katalysatorforskning er nu300 kvaternære katalysatorer udtages tilfældigt fra et stort materialerum, hvor deres ydeevne i forhold til OCM systematisk evalueres ved eksperimenter med høj gennemstrømning, efterfulgt af maskinlær
Takket være maskinlæring, fremtiden for katalysatorforskning er nu300 kvaternære katalysatorer udtages tilfældigt fra et stort materialerum, hvor deres ydeevne i forhold til OCM systematisk evalueres ved eksperimenter med høj gennemstrømning, efterfulgt af maskinlær
- For at se et molekyle skal du bruge en?
- Hvad er kraften i en ciruit med 10 ohmns volt og 2 ampere?
- Startups rystede op på det søvnige barberknivsmarked. Hvad er det næste?
- Forskere observerer gasgentilvækst i døende galakser for første gang
- Hvordan tardigrader overlever dehydrering
- Hvor mange 25 kg i 1 ton?


