Hvorfor er ikke -metaller gode isolatorer?
* Valenselektroner: Ikke -metaller har typisk et stort antal valenselektroner (elektroner i den yderste skal). Disse elektroner er tæt bundet til kernen og er ikke let løsrevet.
* Energihuller: Energifrængningen mellem valensbåndet (hvor elektroner bor) og ledningsbåndet (hvor elektroner kan bevæge sig frit) i ikke -metaller er stort. Dette betyder, at der kræves en masse energi for at begejstre et elektron fra valensbåndet til ledningsbåndet, hvilket gør det vanskeligt for elektroner at flyde.
* kovalent binding: Mange ikke -metaller danner stærke kovalente bindinger, hvor elektroner deles mellem atomer. Denne deling af elektroner fører til en mere stiv struktur med færre frie elektroner til rådighed til ledning.
I modsætning hertil er metaller gode ledere, fordi:
* De har løst holdt valenselektroner, der let kan bevæge sig gennem materialet.
* Deres energigap mellem valence og ledningsbånd er meget lille, hvilket giver elektroner mulighed for at bevæge sig frit med minimal energiindgang.
Kortfattet: Ikke -metallernes tæt bundne elektroner, store energihuller og stærke kovalente bindinger begrænser bevægelsen af elektroner, hvilket gør dem til dårlige ledere og fremragende isolatorer.
 Varme artikler
Varme artikler
-
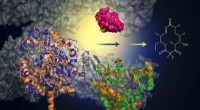 Forskere udvikler grønnere og mere effektiv metode til fremstilling af næste generations antibioti…Med tilføjelsen af en murin-afledt biokatalysator (grøn), kan dette konstruerede protein tilføje et fluoridatom for at skabe makrolidanaloger (struktur, til højre). Denne tilgang tilbyder en grønner
Forskere udvikler grønnere og mere effektiv metode til fremstilling af næste generations antibioti…Med tilføjelsen af en murin-afledt biokatalysator (grøn), kan dette konstruerede protein tilføje et fluoridatom for at skabe makrolidanaloger (struktur, til højre). Denne tilgang tilbyder en grønner -
 Ny katalysator hjælper med at omdanne kuldioxid til brændstofAisulu Aitbekova, venstre, og Matteo Cargnello foran reaktoren, hvor Aitbekova udførte mange af eksperimenterne til dette projekt. Kredit:L.A. Cicero Forestil dig at få fat i kuldioxid fra bilers
Ny katalysator hjælper med at omdanne kuldioxid til brændstofAisulu Aitbekova, venstre, og Matteo Cargnello foran reaktoren, hvor Aitbekova udførte mange af eksperimenterne til dette projekt. Kredit:L.A. Cicero Forestil dig at få fat i kuldioxid fra bilers -
 Forskere syntetiserer gipserstatningNaturlig gipssten. Kredit:Maksim Safaniuk Et internationalt hold af videnskabsmænd har foreslået en metode til fremstilling af højkvalitets gipsbindemidler baseret på syntetisk calciumsulfatdihydr
Forskere syntetiserer gipserstatningNaturlig gipssten. Kredit:Maksim Safaniuk Et internationalt hold af videnskabsmænd har foreslået en metode til fremstilling af højkvalitets gipsbindemidler baseret på syntetisk calciumsulfatdihydr -
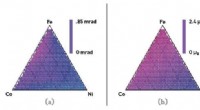 Kombineret datatilgang kan fremskynde udviklingen af nye materialerBilledtekst:(a) Kerr-rotationskortlægning af et jern, kobolt, nikkelkompositspredning ved hjælp af den mere nøjagtige højgennemstrømningsforsøgsmetode, (b) kun høj gennemløbsberegning, og (c) Iwasaki
Kombineret datatilgang kan fremskynde udviklingen af nye materialerBilledtekst:(a) Kerr-rotationskortlægning af et jern, kobolt, nikkelkompositspredning ved hjælp af den mere nøjagtige højgennemstrømningsforsøgsmetode, (b) kun høj gennemløbsberegning, og (c) Iwasaki
- Hvordan underviser vi effektivt i seksuelt samtykke?
- NASA finder, at den tropiske depression kæmper mod vindskydning ud for Carolina-kysten
- Hvilken erklæring beskriver bedst ionisk binding?
- Undersøgelse:Mentalt genbinding til arbejdet, som er vigtigt for lederens succes
- Proteinporer pakket i polymerer laver supereffektive filtreringsmembraner
- On-demand-vacciner mulige med konstruerede nanopartikler


