Hvordan er elektronerne arrangeret omkring kerne og hvordan de påvirker dens reaktivitet?
Elektronarrangement og reaktivitet
Elektroner er arrangeret omkring kernen i et atom i specifikke energiniveauer, kaldet elektronskaller . Hver skal kan have et maksimalt antal elektroner:
* shell 1 (k shell): Holder op til 2 elektroner
* shell 2 (l shell): Holder op til 8 elektroner
* shell 3 (m shell): Holder op til 18 elektroner
* shell 4 (n shell): Holder op til 32 elektroner
Inden for hver skal er elektroner yderligere organiseret i underskaller (S, P, D, F) med forskellige former og energier. Den yderste skal kaldes valence shell , og dens elektroner kaldes valenselektroner .
Reaktivitet bestemmes primært af antallet af valenselektroner og deres arrangement:
* atomer med en fuld valensskal (8 elektroner) er generelt ureaktive eller inerte. De har en stabil konfiguration og er tilfredse med deres elektronarrangement. For eksempel er de ædle gasser (He, NE, AR, KR, XE, RN) inerte på grund af deres fulde valensskaller.
* atomer med færre end 8 valenselektroner er generelt reaktive. De har en tendens til at vinde, miste eller dele elektroner for at opnå en stabil konfiguration med en fuld valensskal.
* Antallet af valenselektroner bestemmer den type kemiske bindinger, et atom kan danne. Atomer med 1-3 valenselektroner har en tendens til at miste elektroner og danne positive ioner (kationer). Atomer med 5-7 valenselektroner har en tendens til at vinde elektroner og danne negative ioner (anioner). Atomer med 4 valenselektroner kan enten miste eller få elektroner eller dele elektroner for at opnå en stabil konfiguration.
Eksempel:
* natrium (NA) har 1 valenselektron. Det mister let dette elektron for at opnå en stabil konfiguration som Neon (NE), der har en fuld valensskal. Dette gør natrium meget reaktiv og danner en kation (Na+).
* klor (Cl) Har 7 valenselektroner. Det får let 1 elektron for at opnå en stabil konfiguration som Argon (AR), der har en fuld valensskal. Dette gør klor meget reaktiv og danner en anion (Cl-).
Yderligere faktorer, der påvirker reaktivitet:
* Elektronegativitet: Et atoms tendens til at tiltrække elektroner mod sig selv. Flere elektronegative atomer er mere tilbøjelige til at vinde elektroner og danne negative ioner, hvilket gør dem mere reaktive.
* ioniseringsenergi: Den energi, der kræves for at fjerne et elektron fra et atom. Atomer med lav ioniseringsenergi er mere tilbøjelige til at miste elektroner og danne positive ioner, hvilket gør dem mere reaktive.
* atomstørrelse: Mindre atomer har en tendens til at være mere reaktive på grund af deres mere koncentrerede elektronskyer, som lettere kan interagere med andre atomer.
At forstå arrangementet af elektroner omkring kernen er afgørende for at forudsige og forklare elementernes reaktivitet. Denne viden hjælper os med at forstå, hvordan atomer kombineres for at danne molekyler, og hvordan kemiske reaktioner forekommer.
Sidste artikelHvilken egenskab ved et stof svarer til gennemsnittet KE -partikler?
Næste artikelHvad er isoleret dirigent?
 Varme artikler
Varme artikler
-
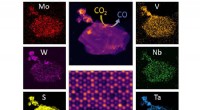 Ny 2D-legering kombinerer fem metaller, nedbryder kuldioxidScanning af transmissionselektronmikroskopbilleder af en højentropiovergangsmetal dichalcogenid-legeringsflage i sin helhed og en atomopløst sektion. Monokromatiske billeder viser fordelingen af for
Ny 2D-legering kombinerer fem metaller, nedbryder kuldioxidScanning af transmissionselektronmikroskopbilleder af en højentropiovergangsmetal dichalcogenid-legeringsflage i sin helhed og en atomopløst sektion. Monokromatiske billeder viser fordelingen af for -
 Enkel vandtest kunne forhindre lammende knoglesygdomDen enkle test skifter farve fra lilla til blå, når fluorindholdet er for højt. Kredit:University of Bath En enkel farveændrende test for at påvise fluor i drikkevand, udtænkt af forskere ved Univ
Enkel vandtest kunne forhindre lammende knoglesygdomDen enkle test skifter farve fra lilla til blå, når fluorindholdet er for højt. Kredit:University of Bath En enkel farveændrende test for at påvise fluor i drikkevand, udtænkt af forskere ved Univ -
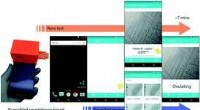 Forskere udvikler smartphone-baseret ægløsningstestKredit: Lab on a Chip (2018). DOI:10.1039/C8LC00792F Efterforskere fra Brigham and Womens Hospital er ved at udvikle en automatiseret, lavprisværktøj til at forudsige en kvindes ægløsning og hjæl
Forskere udvikler smartphone-baseret ægløsningstestKredit: Lab on a Chip (2018). DOI:10.1039/C8LC00792F Efterforskere fra Brigham and Womens Hospital er ved at udvikle en automatiseret, lavprisværktøj til at forudsige en kvindes ægløsning og hjæl -
 En ny måde at kombinere bløde materialer påEn umodificeret hydrogel (til venstre) skræller let af fra en elastomer. En kemisk bundet hydrogel og elastomer (til højre) er svære at skille fra hinanden, efterlader rester efter kredit:Suo Lab/Harv
En ny måde at kombinere bløde materialer påEn umodificeret hydrogel (til venstre) skræller let af fra en elastomer. En kemisk bundet hydrogel og elastomer (til højre) er svære at skille fra hinanden, efterlader rester efter kredit:Suo Lab/Harv
- Orkanen Grace efterlader mindst 8 døde i Mexico
- Når du skubber med en vandret 10-N-kraft på bogen, der forbliver i hvile, hvad er friktionen?
- Brug af elektricitet til at give kemi et løft
- Hvor den nuværende lov er tilfreds i en trefaset ublanceret stjerneforbundet belastning leveret fra…
- Hvad hedder materialer, der transmitterer lys uden spredning?
- Hvad er en periodisk funktion?


