Hvad er mellemrummet mellem partikler af fast væske og gas?
faste stoffer
* meget lidt plads: Partikler i faste stoffer er tæt pakket sammen. De vibrerer på plads, men har ikke meget frihed til at bevæge sig rundt. De små rum mellem dem bidrager til deres faste form og volumen.
væsker
* mere plads end faste stoffer: Partikler i væsker er tættere sammen end i gasser, men de har mere frihed til at bevæge sig rundt. De kan glide forbi hinanden og give væsker deres evne til at flyde. Rummet mellem partikler er større end i faste stoffer, men mindre end i gasser.
Gasser
* Store rum: Partikler i gasser er langt fra hinanden og bevæger sig frit. De kolliderer med hinanden og væggene i deres beholder og forårsager pres. De store rum mellem partikler bidrager til gassens evne til at udvide til at fylde enhver beholder.
visuel analogi
* Forestil dig en mængde mennesker.
* faste stoffer: Folk er tæt pakket og bevæger sig næppe.
* væsker: Folk er tættere end i en gas, men kan stadig bevæge sig lidt rundt.
* Gasser: Folk er spredt vidt og bevæger sig frit.
Key Takeaway: Rummet mellem partikler påvirker direkte egenskaberne ved stof, såsom densitet, kompressibilitet og evne til at flyde.
 Varme artikler
Varme artikler
-
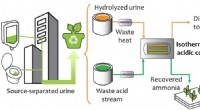 Bæredygtig genvinding af næringsstoffer fra urinUrin, som indeholder det meste af det nitrogen, der udskilles af mennesker, kan isoleres ved kilden via tørre urinaler og urinafledningstoiletter. Gennem isotermisk MD, flygtig ammoniak i hydrolyseret
Bæredygtig genvinding af næringsstoffer fra urinUrin, som indeholder det meste af det nitrogen, der udskilles af mennesker, kan isoleres ved kilden via tørre urinaler og urinafledningstoiletter. Gennem isotermisk MD, flygtig ammoniak i hydrolyseret -
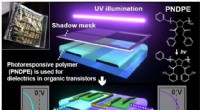 Tuning af fleksible kredsløb med lysFigur 1:Skematisk, der viser processen, der giver mulighed for præcis kontrol af de organiske transistorkarakteristika ved hjælp af lysbestråling. Indsatsen viser et fotografi af den endelige enhed. K
Tuning af fleksible kredsløb med lysFigur 1:Skematisk, der viser processen, der giver mulighed for præcis kontrol af de organiske transistorkarakteristika ved hjælp af lysbestråling. Indsatsen viser et fotografi af den endelige enhed. K -
 Brugereksperiment hos BESSY II—komplekse tesselleringer, ekstraordinære materialerDen nye byggeklods (venstre, rødt omrids) omfatter to modificerede startmolekyler forbundet med hinanden med et sølvatom (blåt). Dette fører til komplekse, semiregulære tesseller (højre, mikroskopbill
Brugereksperiment hos BESSY II—komplekse tesselleringer, ekstraordinære materialerDen nye byggeklods (venstre, rødt omrids) omfatter to modificerede startmolekyler forbundet med hinanden med et sølvatom (blåt). Dette fører til komplekse, semiregulære tesseller (højre, mikroskopbill -
 Forskeren udvikler bæredygtigt grønt te-baseret læderalternativDenne prototype af den grønne te-materialebaserede sko er et bæredygtigt alternativ til lædersko. Det blev skabt af Auburn-forskeren Young-A Lee. Kredit:Auburn University i Montgomery En global be
Forskeren udvikler bæredygtigt grønt te-baseret læderalternativDenne prototype af den grønne te-materialebaserede sko er et bæredygtigt alternativ til lædersko. Det blev skabt af Auburn-forskeren Young-A Lee. Kredit:Auburn University i Montgomery En global be
- Forskere opdager et system med tre planeter på størrelse med Jorden
- Politiske partier bruger gerrymandering til at modvirke skiftende vælgerpræferencer i vigtige kamp…
- Syntetisk kanal med en stærk præference for kaliumioner tilbyder hurtig transport gennem kunstig m…
- Hvad er de forskellige typer funktionsgrunder?
- Sådan finder du miljøvenlige produkter
- Fordele og ulemper ved et UV-VIS Spectrometer


