Hvad forekommer partiklerne for at koge?
1. Øget kinetisk energi: Partiklerne skal absorbere nok energi til at øge deres kinetiske energi, hvilket får dem til at bevæge sig hurtigere og længere fra hinanden. Denne energi kan leveres af varme.
2. overvinde intermolekylære kræfter: Partiklerne er nødt til at overvinde de attraktive kræfter (f.eks. Hydrogenbinding, dipol-dipolinteraktioner, London-spredningskræfter), der holder dem sammen i flydende tilstand.
3. damptryk lig med atmosfærisk tryk: Når væskens damptryk (det tryk, der udøves af de flugtende dampmolekyler) bliver lig med det atmosfæriske tryk, koges væsken. På dette tidspunkt kan væsken forvandles til en gas frit.
i enklere termer:
* varme tilføjes: Dette får væskens partikler til at bevæge sig hurtigere og forsøge at flygte fra væskens overflade.
* Partikler bryder fri: Når nok partikler har nok energi, overvinder de kræfterne, der holder dem sammen og slipper ud i gasfasen.
* kogepunkt: Temperaturen, hvorpå dette sker, er væskens kogepunkt.
Tænk på det sådan: Forestil dig, at du holder en masse kugler sammen med en stærk magnet. Hvis du ryster containeren hårdt nok, vil kuglerne overvinde magnetens kraft og flyve ud. På samme måde får varme, der får flydende partikler til at vibrere så stærkt, at de bryder sig fri og bliver gas.
Sidste artikelHvad er nogle karakteristiske ved faste stoffer?
Næste artikelHvad er ligheden mellem partikler af væsker og faste stoffer?
 Varme artikler
Varme artikler
-
 En fremtid med nyttige konstruerede levende maskiner?Ny blød, mekaniske metamaterialer kan tænke over, hvordan kræfter påføres det og reagere via forprogrammerede reaktioner. Kredit:Jennifer M. McCann / Elizabeth Flores-Gomez Murray, Penn State MR K
En fremtid med nyttige konstruerede levende maskiner?Ny blød, mekaniske metamaterialer kan tænke over, hvordan kræfter påføres det og reagere via forprogrammerede reaktioner. Kredit:Jennifer M. McCann / Elizabeth Flores-Gomez Murray, Penn State MR K -
 Polymerer springer gennem bøjler på vej til bæredygtige materialerKemisk og biomolekylær ingeniørprofessor Charles Schroeder, venstre, og kandidatstuderende Yuecheng (Peter) Zhou studerer flowdynamikken i ring- og lineære polymerløsninger for at aflæse spor om, hvor
Polymerer springer gennem bøjler på vej til bæredygtige materialerKemisk og biomolekylær ingeniørprofessor Charles Schroeder, venstre, og kandidatstuderende Yuecheng (Peter) Zhou studerer flowdynamikken i ring- og lineære polymerløsninger for at aflæse spor om, hvor -
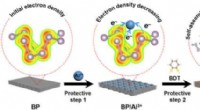 Regulering af reaktiviteten af sort fosfor gennem beskyttende kemiSkematisk illustration af regulering af reaktiviteten af BP via beskyttende kemi. Beskyttelsestrin 1:Binding af Al3+ ioner med ensomme elektronpar på overfladen af P-atomer reducerer overfladeelek
Regulering af reaktiviteten af sort fosfor gennem beskyttende kemiSkematisk illustration af regulering af reaktiviteten af BP via beskyttende kemi. Beskyttelsestrin 1:Binding af Al3+ ioner med ensomme elektronpar på overfladen af P-atomer reducerer overfladeelek -
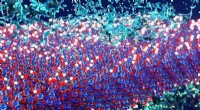 Kemiske ingeniører afslører måder at mønstre faste overflader på for at forbedre, hvordan vand …Konceptkunst, der viser dynamikken i vand (blå-grønne former i top og bund) ved grænsefladen af en membran (blå vandret sektion i midten) med hydrofobe og hydrofile grupper spredt over overfladen Kr
Kemiske ingeniører afslører måder at mønstre faste overflader på for at forbedre, hvordan vand …Konceptkunst, der viser dynamikken i vand (blå-grønne former i top og bund) ved grænsefladen af en membran (blå vandret sektion i midten) med hydrofobe og hydrofile grupper spredt over overfladen Kr
- 'Byform' og boligkrisen:Kan gadebygninger gøre et kvarter mere overkommeligt?
- Er et bærerprotein en aktiv transport eller passiv transport?
- Er en meter afstanden tilbagelagt af en lysstråle i vakuum?
- En ny elektronisk komponent til at erstatte flash-lager
- Ingeniører udvikler smart materiale, der ændrer stivhed, når det drejes eller bøjes
- Sådan konverteres hældningsaflytningsformular til standardformular


