Når molekylerne i en kropsbevægelse med øget hastighed er det muligt, der vil ændre sig fra gas til væske?
* Temperatur og molekylær bevægelse: Temperaturen er et mål for den gennemsnitlige kinetiske energi af molekyler. Når molekyler bevæger sig hurtigere, øges temperaturen.
* faseovergange: Staten med stof (fast, flydende, gas) afhænger af balancen mellem de attraktive kræfter mellem molekyler og deres kinetiske energi.
* gas til væske: For at en gas skal blive en væske, er molekylerne nødt til at bremse og blive mere tiltrukket af hinanden. Dette sker typisk, når varme fjernes (afkøling), hvilket får molekylerne til at miste kinetisk energi og blive tættere sammen.
* væske til gas: Når molekyler i en væskeforstærkning nok kinetisk energi (varme tilsættes), overvinder de de attraktive kræfter, der holder dem sammen og overgår til en gas (fordampning eller kogning).
Tænk på det sådan:
* gas: Forestil dig en flok ophidsede børn, der løber rundt med masser af energi.
* væske: Forestil dig børnene, der bremser lidt, bevæger sig stadig, men tættere sammen.
* fast: Forestil dig børnene, der alle står stille, tæt pakket sammen.
Så stigende molekylær hastighed fører generelt til en faseændring fra væske til gas, ikke omvendt.
Sidste artikelHvad er massen konverteret til i nukleare reaktioner?
Næste artikelHvad måles væsker i liter?
 Varme artikler
Varme artikler
-
 Biomolekyle metal-organiske hybrider med høj bioaktivitetKredit:Wiley Biomakromolekyler inkorporeret i skræddersyede metal-organiske rammer ved hjælp af peptidmodulatorer er godt afskærmede, men yderst aktive takket være omhyggeligt afstemt nanoarkitekt
Biomolekyle metal-organiske hybrider med høj bioaktivitetKredit:Wiley Biomakromolekyler inkorporeret i skræddersyede metal-organiske rammer ved hjælp af peptidmodulatorer er godt afskærmede, men yderst aktive takket være omhyggeligt afstemt nanoarkitekt -
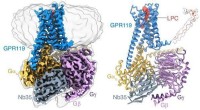 Undersøgelse afslører ligandgenkendelsesmekanisme for forældreløs receptor GPR119Identifikation af LPCet bundet til GPR119-Gs-komplekset ved hjælp af cryo-EM. Kredit:Peiyu Xu fra H. Eric Xus laboratorium Metaboliske sygdomme, herunder diabetes, fedtlever og fedme, er blevet en
Undersøgelse afslører ligandgenkendelsesmekanisme for forældreløs receptor GPR119Identifikation af LPCet bundet til GPR119-Gs-komplekset ved hjælp af cryo-EM. Kredit:Peiyu Xu fra H. Eric Xus laboratorium Metaboliske sygdomme, herunder diabetes, fedtlever og fedme, er blevet en -
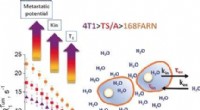 Field-cycling relaxometry kan vurdere tumorstatus ved at måle hastigheden af cellulær vandudveks…Hvor aggressiv er en tumor? For at måle tumorstatus uden at tage vævsprøver, Italienske forskere har udviklet en metode baseret på magnetisk resonansbilleddannelse (MRI) af hele kropsdele. Teknikken m
Field-cycling relaxometry kan vurdere tumorstatus ved at måle hastigheden af cellulær vandudveks…Hvor aggressiv er en tumor? For at måle tumorstatus uden at tage vævsprøver, Italienske forskere har udviklet en metode baseret på magnetisk resonansbilleddannelse (MRI) af hele kropsdele. Teknikken m -
 Vedligeholdelse af veje med drue og landbrugsaffaldXianming Shi tænkte først på at bruge bioteknologi til at udlede tilsætningsstoffer til affald fra landbrugsaffaldsmaterialer for flere år siden, da Alaskas transportministerium fik til opgave at udvi
Vedligeholdelse af veje med drue og landbrugsaffaldXianming Shi tænkte først på at bruge bioteknologi til at udlede tilsætningsstoffer til affald fra landbrugsaffaldsmaterialer for flere år siden, da Alaskas transportministerium fik til opgave at udvi


