Hvilke to regler anvendte på elektroner?
1. Pauli Ekskluderingsprincip: Dette princip siger, at ingen to elektroner i et atom kan have det samme sæt med fire kvantetal. Disse kvantetal beskriver et elektrons energiniveau, orbitalform, orbitalorientering og spin. Dette betyder, at hvert elektron i et atom skal have en unik kombination af disse egenskaber. Dette princip er afgørende for at forstå atomernes elektroniske struktur og hvordan de danner kemiske bindinger.
2. Hunds regel: Denne regel hedder, at når der er fyldt orbitaler med lige energi (degenererede orbitaler), vil elektroner individuelt besætte hver orbital, før de fordobles i en orbital. Endvidere vil elektronerne i enkeltvis besatte orbitaler have den samme spin. Dette betyder, at elektroner foretrækker at sprede sig så meget som muligt og har parallelle spins inden for et underskal. Denne regel hjælper med at forklare stabiliteten af visse elektronkonfigurationer.
Disse regler er grundlæggende for at forstå opførsel af elektroner i atomer og molekyler.
Sidste artikelHvad kalder vi den temperatur, hvormed luft bliver mættet?
Næste artikelHvad er ligningen for alfa -forfald af uran -237?
 Varme artikler
Varme artikler
-
 Hajsikkert våddragtsmateriale kan hjælpe med at redde livEt nyt våddragtsmateriale testet af Flinders havforskere med hvide hajer på Neptunøerne. Kredit:Lektor Charlie Huveneers, Flinders Universitet Et nyt våddragtsmateriale testet af Flinders havforsk
Hajsikkert våddragtsmateriale kan hjælpe med at redde livEt nyt våddragtsmateriale testet af Flinders havforskere med hvide hajer på Neptunøerne. Kredit:Lektor Charlie Huveneers, Flinders Universitet Et nyt våddragtsmateriale testet af Flinders havforsk -
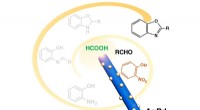 Forskere udvikler miljøvenlige, 4-i-1 katalysatorKatalysatorer som denne nye udviklet på Brown University kan muligvis hjælpe med at gøre industriel kemi mere bæredygtig. Kredit:Sun Lab / Seto Lab / Brown University Brown University-forskere har
Forskere udvikler miljøvenlige, 4-i-1 katalysatorKatalysatorer som denne nye udviklet på Brown University kan muligvis hjælpe med at gøre industriel kemi mere bæredygtig. Kredit:Sun Lab / Seto Lab / Brown University Brown University-forskere har -
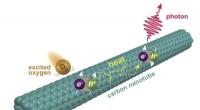 Kemikere får et kig på ny fluorescens i kulstofnanorørKemikere ved Rice University har opdaget et andet niveau af fluorescens i enkeltvæggede kulstofnanorør. Fluorescensen udløses, når oxygenmolekyler exciteret til en singlettilstand interagerer med nano
Kemikere får et kig på ny fluorescens i kulstofnanorørKemikere ved Rice University har opdaget et andet niveau af fluorescens i enkeltvæggede kulstofnanorør. Fluorescensen udløses, når oxygenmolekyler exciteret til en singlettilstand interagerer med nano -
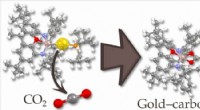 Det første nukleofile guldkompleksEn ny aluminium-guldforbindelse (til venstre) reagerer med kuldioxid ved indsættelse (til højre), hvilket viser guldatomets nukleofile karakter. Kredit:Jyväskylä Universitet En forskningsindsats m
Det første nukleofile guldkompleksEn ny aluminium-guldforbindelse (til venstre) reagerer med kuldioxid ved indsættelse (til højre), hvilket viser guldatomets nukleofile karakter. Kredit:Jyväskylä Universitet En forskningsindsats m
- Høj hale:Marokko sår tvivl om Mexico dinosaur fragment
- Hvide forældre, der føler sig bagud af nutidens økonomi, foretrækker hårdere forældrepraksis, …
- Hvad er energiomdannelsen for et gasfyr?
- Producerer solceller meget energi?
- Fra klippekredsløbet beskrive ændringer, som en sedimentær kunne gennemgå?
- Spektakulære flyvende krybdyr svævede over Storbritanniens tropiske Jurassic fortid


