Hvorfor is ved 273 K er mere effektiv end kølevand samme temparatur?
Nøglen er faseændringen:
* ICEs latente fusionsvarme: Når is smelter, absorberer den en betydelig mængde varmeenergi, kaldet den latente fusionsvarme. Denne energi kommer fra det omgivende vand, hvilket får den til at køle ned.
* Vands specifikke varmekapacitet: Vand har en relativt høj specifik varmekapacitet, hvilket betyder, at det kræver en masse energi at hæve temperaturen. Dette betyder dog også, at det kræver en masse energi at sænke dens temperatur.
hvordan det fungerer:
1. is og vand ved 273 K: Begge er ved den samme temperatur, men isen har potentialet til at absorbere varme, når den smelter.
2. Varmeoverførsel: Når is og vand blandes, strømmer varme fra det varmere vand til den koldere is.
3. is smelter: Isen absorberer varmen, hvilket får den til at smelte. Denne proces tager mere energi end blot at sænke vandets temperatur.
4. køleeffekt: Den varme, der absorberes af den smeltende is, kommer fra det omgivende vand, hvilket får vandet til at køle ned yderligere, end hvis kun vand var til stede.
i enklere termer: Is ved 273 K er som en lille "varmesvamp." Det absorberer varme fra vandet, når det smelter, hvilket effektivt fjerner varmen fra vandet og afkøler den ned.
Vigtig note: Hvis vandet er ved en temperatur under 273 K (0 ° C), ville isen ikke smelte, og der ville ikke være en køleeffekt på grund af faseændringen.
Sidste artikelHvad er nogle egenskaber ved molekylære forbindelser?
Næste artikelHvad er nettoafgiften for et ikke-ioniseret atom?
 Varme artikler
Varme artikler
-
 Forskere udvikler nyt system til undersøgelse af nye krydsbårne sygdommeKredit:stock.adobe.com Krydsbårne sygdomme er stigende, og især en dukker op i USA og Canada. Human babesiose er en infektion, der kan forårsage en række symptomer og endda døden. Lidt er kendt om
Forskere udvikler nyt system til undersøgelse af nye krydsbårne sygdommeKredit:stock.adobe.com Krydsbårne sygdomme er stigende, og især en dukker op i USA og Canada. Human babesiose er en infektion, der kan forårsage en række symptomer og endda døden. Lidt er kendt om -
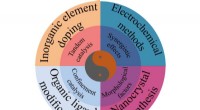 Tuningstrategier og struktureffekter af elektrokatalysatorer til kuldioxidreduktionsreaktionenForskellige afstemningsstrategier muliggør forskelle i katalysatorstrukturer. Hvordan træffer man et valg fra disse tilgængelige tuning-strategier? Der kan foretages en afvejning mellem den ønskede st
Tuningstrategier og struktureffekter af elektrokatalysatorer til kuldioxidreduktionsreaktionenForskellige afstemningsstrategier muliggør forskelle i katalysatorstrukturer. Hvordan træffer man et valg fra disse tilgængelige tuning-strategier? Der kan foretages en afvejning mellem den ønskede st -
 Træbaseret teknologi skaber elektricitet fra varmeKredit:University of Maryland Et team af forskere, der ledes af University of Maryland, har skabt en varme-til-elektricitetsenhed, der kører på ioner, og som en dag kan udnytte kroppens varme for
Træbaseret teknologi skaber elektricitet fra varmeKredit:University of Maryland Et team af forskere, der ledes af University of Maryland, har skabt en varme-til-elektricitetsenhed, der kører på ioner, og som en dag kan udnytte kroppens varme for -
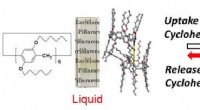 Damp driver en væske -fast overgang i et molekylært systemFigur 1. Skematisk illustration af cyclohexan gæstedampinduceret tilstandsændring af søjle [6] arene med 12 n-hexylgrupper. Kredit:Kanazawa University Den reversible omskiftning af makrocykliske m
Damp driver en væske -fast overgang i et molekylært systemFigur 1. Skematisk illustration af cyclohexan gæstedampinduceret tilstandsændring af søjle [6] arene med 12 n-hexylgrupper. Kredit:Kanazawa University Den reversible omskiftning af makrocykliske m
- Kaster lys på en skyggefuld organisatorisk hub i celler
- Redoxdivergerende strategi til konstruktion af (dihydro)thiophener med dimethylsulfoxid
- Hvilken øjeblikkelig hastighed kan man betragte som størrelsen øjeblikkelig?
- Hvad gør statisk elektricitet?
- Vil lithium få en elektron, når det reagerer og danner en forbindelse?
- Ny røntgenpulsar opdaget


