Hvad er nogle egenskaber ved molekylære forbindelser?
egenskaber ved molekylære forbindelser:
Molekylære forbindelser udviser et distinkt sæt egenskaber sammenlignet med ioniske forbindelser. Her er nogle nøgleegenskaber:
Fysiske egenskaber:
* lavere smeltnings- og kogepunkter: Molekylære forbindelser har generelt svagere intermolekylære kræfter (som van der Waals -kræfter eller hydrogenbinding) sammenlignet med de stærke elektrostatiske interaktioner i ioniske forbindelser. Dette fører til lavere smelte- og kogepunkter.
* ofte gasser eller væsker ved stuetemperatur: På grund af deres svagere intermolekylære kræfter findes der mange molekylære forbindelser som gasser eller væsker ved stuetemperatur.
* dårlig elektrisk ledningsevne: Molekylære forbindelser udfører generelt ikke elektricitet i den faste eller flydende tilstand, fordi de ikke har frit bevægende ladede partikler som ioner.
* Ofte opløselig i ikke -polære opløsningsmidler: Molekylære forbindelser har en tendens til at opløses i ikke -polære opløsningsmidler som hexan eller carbontetrachlorid, fordi de har lignende intermolekylære kræfter.
* kan være faste stoffer, væsker eller gasser ved stuetemperatur: Mens mange er væsker eller gasser, er der også faste molekylære forbindelser.
* kan være sprød eller fleksibel afhængigt af struktur: Nogle molekylære forbindelser er sprøde (som sukker), mens andre er fleksible (som gummi).
Kemiske egenskaber:
* kovalent binding: De dannes ved deling af elektroner mellem atomer og danner kovalente bindinger.
* Variabel sammensætning: I modsætning til ioniske forbindelser med et fast forhold mellem elementer, kan molekylære forbindelser have forskellige forhold mellem atomer i deres molekyler, hvilket fører til forskellige forbindelser.
* langsommere reaktionshastigheder: Reaktioner, der involverer molekylære forbindelser, forekommer ofte langsommere end dem, der involverer ioniske forbindelser, fordi brud på kovalente bindinger kræver mere energi.
* kan være brandfarlig eller brændbar: Mange molekylære forbindelser, især dem, der indeholder kulstof og brint, er brandfarlige eller brændbare.
* kan være sur, grundlæggende eller neutral: Egenskaberne ved en molekylær forbindelse kan variere afhængigt af de tilstedeværende funktionelle grupper.
Eksempler på molekylære forbindelser:
* Vand (H₂O)
* Kuldioxid (co₂)
* Glukose (c₆h₁₂o₆)
* Ethanol (c₂h₅oh)
* Metan (ch₄)
* Ammoniak (NH₃)
Husk, at dette er generelle tendenser, og at der altid er undtagelser. Imidlertid kan forståelse af disse egenskaber være nyttige til at forudsige opførsel af molekylære forbindelser.
Sidste artikelHvorfor er forbindelser gode isolatorer?
Næste artikelHvorfor is ved 273 K er mere effektiv end kølevand samme temparatur?
 Varme artikler
Varme artikler
-
 Turboladning af brændselsceller med en multifunktionel katalysatorEt nyt boost til brændselscelleteknologi fra Georgia Tech:En nanopartikelbelægning på denne disk turbolader forarbejdning af ilt på katodeenden af faste oxidbrændselsceller, øger den otte gange nuvæ
Turboladning af brændselsceller med en multifunktionel katalysatorEt nyt boost til brændselscelleteknologi fra Georgia Tech:En nanopartikelbelægning på denne disk turbolader forarbejdning af ilt på katodeenden af faste oxidbrændselsceller, øger den otte gange nuvæ -
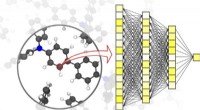 Maskinlæring fremskynder simuleringer inden for materialevidenskabNeurale netværk muliggør præcise simuleringer inden for materialevidenskab – ned til niveauet af individuelle atomer. Kredit:Pascal Friedrich, SÆT Forskning, udvikling, og produktion af nye materi
Maskinlæring fremskynder simuleringer inden for materialevidenskabNeurale netværk muliggør præcise simuleringer inden for materialevidenskab – ned til niveauet af individuelle atomer. Kredit:Pascal Friedrich, SÆT Forskning, udvikling, og produktion af nye materi -
 Forskning afslørede den første krystalstruktur nogensinde af dopamin 2-receptoren bundet til et an…Fuld kemisk struktur af dopamin 2 -receptoren bundet til det antipsykotiske lægemiddel risperidon. Kredit:Roth Lab, UNC School of Medicine Selv om antipsykotiske lægemidler er blandt de mest fores
Forskning afslørede den første krystalstruktur nogensinde af dopamin 2-receptoren bundet til et an…Fuld kemisk struktur af dopamin 2 -receptoren bundet til det antipsykotiske lægemiddel risperidon. Kredit:Roth Lab, UNC School of Medicine Selv om antipsykotiske lægemidler er blandt de mest fores -
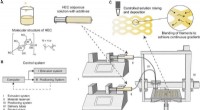 Additiv fremstilling af cellulosebaserede materialer med kontinuerlig, stigninger i flere retningerSkema af fremstillingsprocessen til udskrivning af kontinuerlige gradienter. (A) Skematisk fremstilling af udskrivningsløsninger. Hydroxyethylcellulose (HEC) i pulverform opløses i vand og blandes med
Additiv fremstilling af cellulosebaserede materialer med kontinuerlig, stigninger i flere retningerSkema af fremstillingsprocessen til udskrivning af kontinuerlige gradienter. (A) Skematisk fremstilling af udskrivningsløsninger. Hydroxyethylcellulose (HEC) i pulverform opløses i vand og blandes med
- Hvor på det periodiske tabel er mest reaktivt ikke -metal?
- Tidligt liv på Jorden begrænset af enzym
- Hvad er videnskabsrelateret besættelse?
- Hvordan rejser det meste af energien fra solen til jordoverfladen?
- Etiske regler påvirker ikke softwareudvikleres beslutninger
- Hvad er en god måde at sepperatopløsning af såsom salt fra opløsninger?


