Forskning afslørede den første krystalstruktur nogensinde af dopamin 2-receptoren bundet til et antipsykotisk lægemiddel

Fuld kemisk struktur af dopamin 2 -receptoren bundet til det antipsykotiske lægemiddel risperidon. Kredit:Roth Lab, UNC School of Medicine
Selv om antipsykotiske lægemidler er blandt de mest foreskrevne lægemidler, personer med skizofreni, bipolar lidelse og autismespektrumforstyrrelser oplever ofte alvorlige bivirkninger, fordi stofferne interagerer med snesevis af andre hjerneceptorer. Nu, forskere ved UNC School of Medicine og UC San Francisco (UCSF) har løst den første højopløselige krystalstruktur af dopamin 2-receptoren (DRD2) bundet til det antipsykotiske lægemiddel risperidon, giver et længe ventet værktøj til lægemiddeludviklere, psykiatere, og neurovidenskabsfolk.
Forskningen, udgivet i Natur , vil give forskere mulighed for selektivt at aktivere DRD2 og dermed potentielt begrænse et væld af alvorlige antipsykotiske lægemiddelbivirkninger såsom vægtforøgelse, angst, svimmelhed, alvorlige fordøjelsesproblemer, agitation, og mange andre.
"Hvis vi vil skabe bedre medicin, det første trin er at se, hvordan D2-receptoren ser ud i detaljer i høj opløsning, når den er bundet tæt til et lægemiddel, "sagde seniorforfatter Bryan L. Roth, MD, Ph.d., Michael Hooker Distinguished Professor of Protein Therapeutics and Translational Proteomics ved UNC School of Medicine. "Vi har nu strukturen, og vi undersøger det for at finde nye forbindelser, vi håber kan hjælpe de millioner af mennesker, der har brug for bedre behandlinger. "
Omkring 30 procent af medicinen på markedet aktiverer G-proteinkoblede receptorer på celleoverflader og udløser kemiske signaler inde i cellerne for at give deres terapeutiske virkninger. For antipsykotiske lægemidler, en effekt er at lindre psykotiske symptomer forbundet med skizofreni, bipolar lidelse og mange andre psykiatriske sygdomme. Desværre, fordi forskere ikke har forstået de strukturelle forskelle mellem de mange forskellige slags receptorer i hjernen, de fleste lægemidler kan ikke være designet til kun at målrette mod en type receptor; de interagerer med ikke kun DRD2, men et utal af anden dopamin, serotonin, histamin, og alfa -adrenerge receptorer, fører til alvorlige bivirkninger.
DRD2 har gennemgået omfattende undersøgelser i 30 år, men indtil nu manglede forskere en struktur med høj opløsning af DRD2 knyttet til en forbindelse. Risperidon er en almindeligt foreskrevet antipsykotisk medicin, som er FDA -godkendt til brug ved skizofreni, maniodepressiv, og autismespektrumforstyrrelse. Risperidon er også en af de meget få 'atypiske' antipsykotiske lægemidler, der er godkendt til brug hos børn.
"Med denne højopløselige struktur i hånden, vi forudser opdagelsen af forbindelser, der interagerer med DRD2 på bestemte måder, der er vigtige for større terapeutiske handlinger og færre bivirkninger, "Sagde Roth.
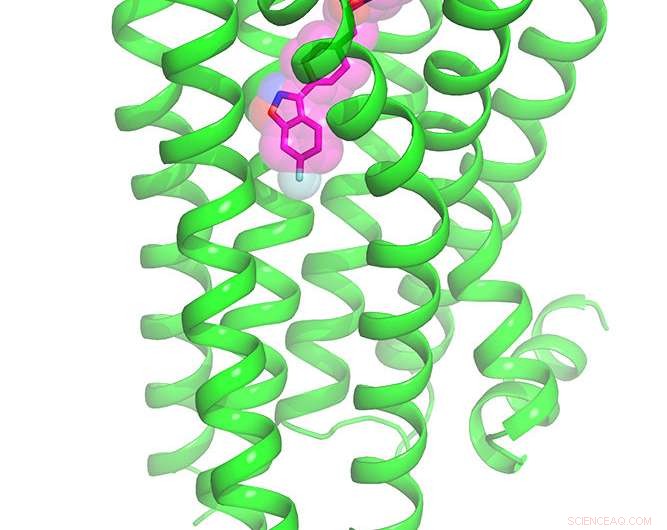
Illustration af dopamin 2 -receptoren bundet til det antipsykotiske lægemiddel risperidon. Kredit:Roth Lab, UNC School of Medicine
Typisk har forskere løst den kemiske struktur af proteiner ved hjælp af en teknik kaldet røntgenkrystallografi. De bruger eksperimentelle metoder til at få proteinet til at kondensere til et tæt pakket krystalgitter, skyder derefter røntgenstråler mod krystallen, og endelig beregne proteinets struktur ud fra de resulterende diffraktionsmønstre. Imidlertid, at få DRD2 -proteinet til at krystallisere med et lægemiddel bundet til det havde været umuligt i årtier, fordi receptorer er notorisk ustabile proteiner - små, skrøbelig, og typisk i bevægelse, da de binder sig til forbindelser.
For at overskride de tekniske udfordringer, Roth og UNC kolleger, herunder postdoktorer Sheng Wang, Ph.d., og Daniel Wacker, Ph.d., gennemført en række omhyggelige undersøgelser over flere år - skitseret i Natur papir - for at lokke DRD2 til at krystallisere, mens det er tæt bundet til risperidon.
Når de havde et billede i høj opløsning, de kunne se, at risperidon binder til DRD2 på en helt uventet måde. Yderligere beregningsmodellering udført af UCSF -forskere Brian Shoichet, Ph.d., og Anat Levit, Ph.d., afslørede, at risperidons bindingsmetode var uforudsigelig - der var en tidligere usynlig lomme på receptoren, som Roth og kolleger mener, kunne målrettes mod at skabe mere selektiv medicin.
"Nu hvor vi kan se de strukturelle forskelle mellem lignende receptorer, såsom dopamin D4 -receptoren og DRD2, vi kan forestille os nye metoder til at skabe forbindelser, der kun binder til DRD2 uden at interagere med snesevis af andre hjerneceptorer. "sagde Wacker, co-tilsvarende forfatter til undersøgelsen. "Det er netop den slags oplysninger, vi har brug for for at skabe sikrere og mere effektive terapier."
Bivirkninger af antipsykotiske lægemidler omfatter ekstrapyramidale symptomer, såsom Parkinson ufrivillig muskelbevægelse. Wang sagde, "Nu hvor vi har løst strukturen af risperidon bundet til DRD2, vi får en idé om, hvordan disse bivirkninger kan undgås. "
Roth tilføjede, "Inden vi kom til UNC, Jeg var en psykiater med speciale i behandling af skizofreni. Dagligt var det klart for mig, at medicin kun var beskedent effektiv for et stort antal patienter. Vores mangel på viden om, hvordan antipsykotiske lægemidler binder sig til deres receptorer, har forhindret fremskridt i retning af at skabe mere effektive lægemidler. At løse krystalstrukturen i høj opløsning af DRD2 bundet til det almindeligt foreskrevne antipsykotiske lægemiddel risperidon er det første skridt i retning af oprettelsen af sikrere og mere effektive lægemidler mod skizofreni og relaterede lidelser. "
 Varme artikler
Varme artikler
-
 Fremtiden for biobrændstoffer i mørketLab-dyrkede alger. Kredit:Elizabeth Hann/UCR Alger kunne konkurrere med petroleum som fremtidens brændstof, hvis blot processen med at dyrke det var mere effektiv. Takket være et stipendium fra Li
Fremtiden for biobrændstoffer i mørketLab-dyrkede alger. Kredit:Elizabeth Hann/UCR Alger kunne konkurrere med petroleum som fremtidens brændstof, hvis blot processen med at dyrke det var mere effektiv. Takket være et stipendium fra Li -
 At spionere på cellers spisevaner kan hjælpe med at diagnosticere kræftForskere har udviklet en ny billedteknologi til at visualisere, hvad celler spiser, som kunne hjælpe med diagnosticering og behandling af sygdomme som kræft. Holdet har designet kemiske sonder, der ly
At spionere på cellers spisevaner kan hjælpe med at diagnosticere kræftForskere har udviklet en ny billedteknologi til at visualisere, hvad celler spiser, som kunne hjælpe med diagnosticering og behandling af sygdomme som kræft. Holdet har designet kemiske sonder, der ly -
 Metal forenkler syntesen af antistoflægemidlerRice University-kemikere har designet et plug-in metalloprotein for at forenkle opgaven med at lave målrettede antistofterapier. Forskerne brugte et tredobbeltmetaliseret peptid (indsat) til at give e
Metal forenkler syntesen af antistoflægemidlerRice University-kemikere har designet et plug-in metalloprotein for at forenkle opgaven med at lave målrettede antistofterapier. Forskerne brugte et tredobbeltmetaliseret peptid (indsat) til at give e -
 Forskere anvender ion blød landingsteknik til fremskridt inden for materialesynteseForskere ved Pacific Northwest National Laboratory og Purdue University samarbejdede om at udarbejde en inviteret anmeldelsesartikel om blød landing af ioner, hvilket er hvor en stråle af udvalgte kom
Forskere anvender ion blød landingsteknik til fremskridt inden for materialesynteseForskere ved Pacific Northwest National Laboratory og Purdue University samarbejdede om at udarbejde en inviteret anmeldelsesartikel om blød landing af ioner, hvilket er hvor en stråle af udvalgte kom
- Vi har kortlagt en million tidligere uopdagede galakser ud over Mælkevejen. Tag den virtuelle rundt…
- En ny solcreme, der ikke trænger ind i huden
- Australsk gas - mellem en revet sten og et socialt hårdt sted
- Forskere dokumenterer de ældste kendte træer i det østlige Nordamerika
- Stort spring mod datalagring på molekylært niveau
- Astrophysicists 2004-teori bekræftede:Hvorfor Solens sammensætning varierer


