Hvorfor kontraheres stoffer, når de afkøles?
* kinetisk energi og temperatur: Temperaturen er et mål for den gennemsnitlige kinetiske energi af partiklerne i et stof. Højere temperaturer betyder, at partikler bevæger sig hurtigere og har mere kinetisk energi.
* Partikelbevægelse og afstand: Når partikler bevæger sig hurtigere, kolliderer de oftere og med større kraft. Dette får dem til at skubbe mod hinanden og opretholde en større gennemsnitlig adskillelse.
* afkøling og reduceret bevægelse: Når et stof afkøles, mister dets partikler kinetisk energi og bremser. Dette resulterer i mindre hyppige og svagere kollisioner, så partiklerne kan komme tættere sammen.
* sammentrækning: Den tættere afstand af partikler fører til et fald i det samlede volumen af stoffet, hvilket er det, vi observerer som sammentrækning.
Undtagelser: Vand er en bemærkelsesværdig undtagelse fra denne regel. Når vand afkøles fra 4 ° C til 0 ° C, udvides det i stedet for at indgå kontrakt. Dette skyldes den unikke struktur af vandmolekyler, der danner brintbindinger, der skaber en åben, mindre tæt struktur i fast is.
Kortfattet: Afkøling af et stof reducerer den kinetiske energi fra sine partikler, hvilket får dem til at bevæge sig tættere sammen og resultere i et fald i volumen. Dette fænomen er grundlaget for sammentrækning.
Sidste artikelAktivitet for at vise, at vand er dårlig varsleder?
Næste artikelHvilken erklæring matcher en subatomik med dens gebyr?
 Varme artikler
Varme artikler
-
 Opdagelse af naturligt chirale overflader til sikrere lægemidlerDe to ikke-overlejrede spejlbilleder af en chiral metaloverflade på atomskala. Kredit:Professor Andrew Gellman I 1960erne, det beroligende middel thalidomid var meget populært som et af de eneste
Opdagelse af naturligt chirale overflader til sikrere lægemidlerDe to ikke-overlejrede spejlbilleder af en chiral metaloverflade på atomskala. Kredit:Professor Andrew Gellman I 1960erne, det beroligende middel thalidomid var meget populært som et af de eneste -
 Fremskyndelse af klinisk brug af Raman-spektroskopi-kemiske fingeraftrykAfbildning af den relative andel af forskellige signalkilder i en menneskelig hjernemåling foretaget ved hjælp af et Raman-spektroskopisystem. Fra fig. 1, doi:10.1117/1.JBO.25.4.040501 Kredit:SPIE
Fremskyndelse af klinisk brug af Raman-spektroskopi-kemiske fingeraftrykAfbildning af den relative andel af forskellige signalkilder i en menneskelig hjernemåling foretaget ved hjælp af et Raman-spektroskopisystem. Fra fig. 1, doi:10.1117/1.JBO.25.4.040501 Kredit:SPIE -
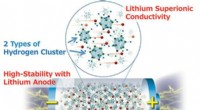 Ny forskning viser, at den højeste energitæthed af alle solid-state-batterier nu er muligHøj-energi-densitet hel-solid-state lithium metalbatteri, der anvender komplekse hydrider. Kredit:Sangryun Kim og Shin-ichi Orimo Forskere fra Tohoku University og High Energy Accelerator Research
Ny forskning viser, at den højeste energitæthed af alle solid-state-batterier nu er muligHøj-energi-densitet hel-solid-state lithium metalbatteri, der anvender komplekse hydrider. Kredit:Sangryun Kim og Shin-ichi Orimo Forskere fra Tohoku University og High Energy Accelerator Research -
 Passer én størrelse alle? En ny model for organiske halvledereRepræsentation af bærermobilitet i hårde uorganiske materialer (øverste figur, båndtransport) og fleksible organiske faste stoffer (nedre tal, fleksibilitetsinduceret transportmekanisme). Kredit:Kazuy
Passer én størrelse alle? En ny model for organiske halvledereRepræsentation af bærermobilitet i hårde uorganiske materialer (øverste figur, båndtransport) og fleksible organiske faste stoffer (nedre tal, fleksibilitetsinduceret transportmekanisme). Kredit:Kazuy
- Ubalanceret ligning for fast zink plus oxygen giver II-oxid?
- Hvilket jordlag er konvektionsstrømme, der direkte resulterer i tektonisk pladebevægelse fundet?
- Hvor meget energi (i Joules) besidder en 3 kg vase, når den placeres på hylde 2,5 meter over jorde…
- Skatkammer af nye opdagelser fremhæver huller i koralviden
- Orkanen Sally truer Gulf Coast med en langsom gennemvædning
- Enorme sværme af myg lærer om indbyrdes forbundne landskaber


