Hvorfor har en gas to værdier af molær varmekapacitet?
1. Molær varmekapacitet ved konstant volumen (CV):
* Dette repræsenterer den mængde varme, der kræves for at hæve temperaturen på en mol gas med en grad Celsius , mens volumenet er konstant .
* I dette tilfælde går den absorberede varme helt til at øge den indre energi (kinetisk energi) af gasmolekylerne.
* Intet arbejde udføres af gassen, da volumenet forbliver konstant.
2. Molær varmekapacitet ved konstant tryk (CP):
* Dette repræsenterer mængden af varme, der kræves for at hæve temperaturen på en mol gas med en grad Celsius , mens trykket er konstant .
* I dette tilfælde går nogle af de absorberede varme til at øge den indre energi i gasmolekylerne, men nogle går også til at arbejde mod det ydre tryk Når lydstyrken udvides.
* Da der er behov for arbejde, er der behov for mere varme for at opnå den samme temperaturændring sammenlignet med konstante volumenbetingelser.
Forholdet mellem CP og CV:
* Forskellen mellem CP og CV er direkte relateret til mængden af arbejde, der udføres mod det eksterne tryk. Denne forskel udtrykkes normalt som:
cp - cv =r
hvor R er den ideelle gaskonstant.
Kortfattet:
De to værdier af molær varmekapacitet for en gas afspejler det faktum, at varme kan absorberes af gassen på to måder:øge intern energi og udføre arbejde mod det ydre tryk. Forskellen mellem disse to værdier stammer fra mængden af udført arbejde, som er afhængig af, om volumen eller trykket holdes konstant under varmeabsorptionen.
Sidste artikelHvad er 5 stoffer, der synker i vand?
Næste artikelHvad hedder reaktionen, der forekommer i en atomreaktorkerne?
 Varme artikler
Varme artikler
-
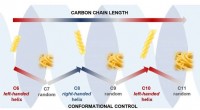 Kulstofkæder antager fusilli- eller spaghetti-former, hvis de har ulige eller lige talBilledet viser, hvordan konformationen (formen) af vores carbonkæder veksler mellem ordnede og kaotiske strukturer, da carbonkæden veksler mellem at have lige og ulige antal atomer. Kredit:University
Kulstofkæder antager fusilli- eller spaghetti-former, hvis de har ulige eller lige talBilledet viser, hvordan konformationen (formen) af vores carbonkæder veksler mellem ordnede og kaotiske strukturer, da carbonkæden veksler mellem at have lige og ulige antal atomer. Kredit:University -
 Carbon black genanvendes fra bildækTop, primærprodukt fra venstre til højre:rå rCB, ren rCB (96+), ren rCB med perler (96+). Bund, sekundære produkter genvundet fra asken, fra venstre til højre:flydende natriumsilicat eller vandglas, u
Carbon black genanvendes fra bildækTop, primærprodukt fra venstre til højre:rå rCB, ren rCB (96+), ren rCB med perler (96+). Bund, sekundære produkter genvundet fra asken, fra venstre til højre:flydende natriumsilicat eller vandglas, u -
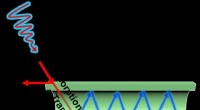 Tuning rør for bedre katalysatorerAbsorberet lys spredes gennem et titaniumoxid fotokatalytisk rør. Kredit:University of Southern Queensland 2020 Titandioxid (TiO 2 ) har betydelig kraft som fotokatalysator - et materiale, der f
Tuning rør for bedre katalysatorerAbsorberet lys spredes gennem et titaniumoxid fotokatalytisk rør. Kredit:University of Southern Queensland 2020 Titandioxid (TiO 2 ) har betydelig kraft som fotokatalysator - et materiale, der f -
 Undersøger virkningerne af fugt og tørring på cementEt nærbillede af porennetværket til en prøve af cement. Kredit:Katerina Ioannidou, et al Selvom det bruges til at konstruere nogle af verdens største strukturer, det viser sig, at cement faktisk h
Undersøger virkningerne af fugt og tørring på cementEt nærbillede af porennetværket til en prøve af cement. Kredit:Katerina Ioannidou, et al Selvom det bruges til at konstruere nogle af verdens største strukturer, det viser sig, at cement faktisk h
- Direkte blækskrivning af højopløselige cellulosestrukturer
- 15 døde efter kraftig regn, oversvømmelser i Kinas kulregion
- Which US river is the transportation artery that travels from north to south?
- Kvantesystemer og biens flugt
- Hvordan endte månen, hvor den er?
- Solenergihoveder i en ny retning:tyndere


