Hvorfor en gas ikke har nogen bestemt form og volumen?
1. Svage intermolekylære kræfter:
* Gaspartikler er langt fra hinanden sammenlignet med faste stoffer og væsker.
* De attraktive kræfter mellem disse partikler (van der Waals -styrker) er meget svage.
* Dette betyder, at partiklerne bevæger sig frit og uafhængigt med lidt interaktion.
2. Konstant tilfældig bevægelse:
* Gaspartikler er i konstant, hurtig og tilfældig bevægelse.
* De kolliderer med hinanden og væggene i deres beholder og skaber pres.
* Denne bevægelse gør det umuligt at begrænse dem til en bestemt form.
3. Fyld containeren:
* På grund af deres svage kræfter og tilfældige bevægelse spredte gaspartikler sig for at fylde hele volumenet på deres beholder.
* De vil udvide sig til at udfylde ethvert rum, de får.
I modsætning til faste stoffer og væsker:
* faste stoffer: Har stærke intermolekylære kræfter, der holder partikler i faste positioner, hvilket giver dem en bestemt form og volumen.
* væsker: Har svagere kræfter end faste stoffer, så partiklerne kan bevæge sig rundt, hvilket giver dem et bestemt volumen, men ikke en bestemt form.
Tænk på det på denne måde:
Forestil dig et værelse fuld af mennesker. Hvis alle er pakket tæt sammen (som en solid), har de en bestemt form og volumen. Hvis alle står rundt, men stadig tæt (som en væske), har de et bestemt volumen, men ikke en bestemt form. Forestil dig nu, at alle løber rundt frit og støder på hinanden (som en gas). De har ingen bestemt form eller volumen, fordi de konstant bevæger sig og fylder hele rummet i rummet.
 Varme artikler
Varme artikler
-
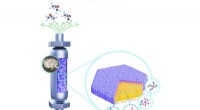 Bindemiddelfri MWW-type titanosilikat til selektiv og holdbar propylenepoxideringForskere designet og forberedte en struktureret bindemiddelfri Ti-MWW katalysator via en kombinationsmetode til formning, omkrystallisation og kemisk modifikation af aktive Ti-steder. Som resultat, de
Bindemiddelfri MWW-type titanosilikat til selektiv og holdbar propylenepoxideringForskere designet og forberedte en struktureret bindemiddelfri Ti-MWW katalysator via en kombinationsmetode til formning, omkrystallisation og kemisk modifikation af aktive Ti-steder. Som resultat, de -
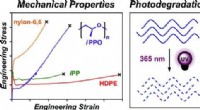 Kemikere skaber hurtigere nedbrydende plast til marinebrugKredit:ACS For at løse plastikmiljøkrisen, Cornell-kemikere har udviklet en ny polymer med rigelig styrke i marine omgivelser, der er klar til at nedbrydes af ultraviolet stråling, ifølge forsknin
Kemikere skaber hurtigere nedbrydende plast til marinebrugKredit:ACS For at løse plastikmiljøkrisen, Cornell-kemikere har udviklet en ny polymer med rigelig styrke i marine omgivelser, der er klar til at nedbrydes af ultraviolet stråling, ifølge forsknin -
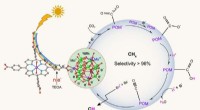 Polyoxometalat-baserede koordinationsrammer for metangenerering i fotoreduktion af kuldioxidPOMCF til konvertering af CO2 til CH4 i fotoreduktionssystem Kredit:©Science China Press Overdreven CO 2 udledning fra vedvarende afbrænding af fossile brændstoffer har forårsaget global opvarmn
Polyoxometalat-baserede koordinationsrammer for metangenerering i fotoreduktion af kuldioxidPOMCF til konvertering af CO2 til CH4 i fotoreduktionssystem Kredit:©Science China Press Overdreven CO 2 udledning fra vedvarende afbrænding af fossile brændstoffer har forårsaget global opvarmn -
 At gøre alkohol til nøgleingredienser til ny medicinForskere har fundet en måde at omdanne alkohol til aminosyrer, afgørende komponenter i mange lægemidler. Kredit:Unsplash Kemikere har fundet en måde at omdanne alkohol til aminosyrer, livets bygge
At gøre alkohol til nøgleingredienser til ny medicinForskere har fundet en måde at omdanne alkohol til aminosyrer, afgørende komponenter i mange lægemidler. Kredit:Unsplash Kemikere har fundet en måde at omdanne alkohol til aminosyrer, livets bygge
- Sådan fungerer CO2 -skrubning
- Et eksempel på en underjordisk grundvandsmagasin?
- Hvad sker der med objektet, når elektricitet rejser gennem det?
- Hvordan kunne det regne i 45 lige dage?
- Hvad er studiet af naturlig proces, der forekommer i miljøet, og hvordan mennesker kan påvirke dem…
- Boeing CEO ser ny efterspørgsel i Kina efter fly


