Er CO2 en god elektrisk leder?
Her er hvorfor:
* molekylær struktur: CO2 -molekyler er ikke -polære og har en lineær struktur. Dette betyder, at de ikke har frie elektroner, der let kan bevæge sig og bære en elektrisk strøm.
* binding: De kulstof- og iltatomer i CO2 holdes sammen af stærke kovalente bindinger. Disse obligationer er meget stabile og bryder ikke let for at frigive frie elektroner.
* isolerende egenskaber: Faktisk bruges CO2 ofte som en isolerende gas i nogle anvendelser på grund af dens dårlige elektriske ledningsevne.
Undtagelser:
* Plasmatilstand: I sin plasmatilstand (ved ekstremt høje temperaturer) kan CO2 blive ledende. Dette skyldes, at den intense varme bryder molekylerne fra hinanden og skaber frie elektroner og ioner.
* urenheder: Hvis CO2 indeholder urenheder som vanddamp eller andre ledende partikler, kan dens ledningsevne stige lidt.
Samlet set er CO2 under normale forhold en meget dårlig leder af elektricitet.
 Varme artikler
Varme artikler
-
 Forskere finder, at frøskal kunne føre til stærke, hård, men alligevel fleksible materialerKarakteristiske træk ved frøkappen af Portulaca oleracea , en årlig sukkulent almindeligvis kendt som verdolaga eller portulak. A) Foto af P. oleracea blomst , B) Fotografi af de bittesmå sorte fr
Forskere finder, at frøskal kunne føre til stærke, hård, men alligevel fleksible materialerKarakteristiske træk ved frøkappen af Portulaca oleracea , en årlig sukkulent almindeligvis kendt som verdolaga eller portulak. A) Foto af P. oleracea blomst , B) Fotografi af de bittesmå sorte fr -
 Vurdering af salens potentielle aktivitet mod proteiner af SARS-CoV-2Ifølge videnskabsmænd er salen - stoffet på billedet - relativt simpelt og billigt at syntetisere. Kredit:UrFU / Damir Safin Forskere fandt ud af, at salen effektivt er i stand til at binde en rækk
Vurdering af salens potentielle aktivitet mod proteiner af SARS-CoV-2Ifølge videnskabsmænd er salen - stoffet på billedet - relativt simpelt og billigt at syntetisere. Kredit:UrFU / Damir Safin Forskere fandt ud af, at salen effektivt er i stand til at binde en rækk -
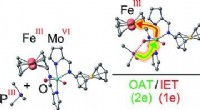 Bioinspireret enzymmodel med redox -switchKredit:Wiley Koblede oxygenoverførsler og elektronoverførselsreaktioner, der anvender kofaktorer, er enzymatiske reaktioner af afgørende betydning for alle livsformer fra bakterier til hvirveldyr.
Bioinspireret enzymmodel med redox -switchKredit:Wiley Koblede oxygenoverførsler og elektronoverførselsreaktioner, der anvender kofaktorer, er enzymatiske reaktioner af afgørende betydning for alle livsformer fra bakterier til hvirveldyr. -
 Smart bulkplast reagerer på lys, temperatur og fugtighedKredit:Unsplash/CC0 Public Domain Forestil dig, at produkter har en længere holdbarhed på grund af smart emballage, at plastikrobotter er drevet af deres miljø, og at tøjet tilpasser sig, mens det
Smart bulkplast reagerer på lys, temperatur og fugtighedKredit:Unsplash/CC0 Public Domain Forestil dig, at produkter har en længere holdbarhed på grund af smart emballage, at plastikrobotter er drevet af deres miljø, og at tøjet tilpasser sig, mens det
- Gips som landbrugsprodukt
- Hvad er to ting, som mængden af tyngdekraft mellem odjekter afhængigt af?
- Hvad svarer til 1,0 V i fysik?
- I oliebaseret muddertest Hvad er elektricitetsstabilitet til?
- Sådan sporer du en haj:Ny forskning afslører, hvor, hvorfor og hvordan hajer vildtfisk overlapper …
- Hvilke geologiske aldre var Athyris i live?


