Hvilken tilstand af materie kontrakter mere, når de afkøles?
Her er hvorfor:
* faste stoffer: Molekylerne i et fast stof er tæt pakket og har et fast arrangement. Afkøling af en fast reducerer molekylernes kinetiske energi, hvilket får dem til at vibrere mindre. Dette medfører et lille fald i volumen, men ændringen er normalt minimal sammenlignet med væsker.
* væsker: Væsker har molekyler, der er mere løst pakket end faste stoffer og kan bevæge sig mere frit. Når de afkøles, bremser molekylerne og bevæger sig tættere sammen, hvilket resulterer i en mere markant sammentrækning i volumen.
* Gasser: Gasser er meget komprimerbare på grund af deres vidt adskilte molekyler. Afkøling af en gas får molekylerne til at bremse og kollidere mindre hyppigt, hvilket fører til et markant fald i volumen. Imidlertid er ændringen i volumen for en gas typisk meget større end for en væske eller fast stof.
Undtagelser:
Mens væsker generelt sammentrækker mere end faste stoffer, når de afkøles, er der nogle undtagelser:
* Vand: Vand er unikt, fordi det udvides, når det afkøles fra 4 ° C til 0 ° C. Dette skyldes dannelsen af brintbindinger mellem vandmolekyler.
* amorfe faste stoffer: Disse faste stoffer har ikke en fast krystallinsk struktur som almindelige faste stoffer. Deres opførsel kan undertiden være tættere på væsker, og de kan udvise mere markant sammentrækning ved afkøling.
Kortfattet: Selvom gasser oplever de største volumenændringer med temperatur, kontraherer væsker normalt mere end faste stoffer, når de afkøles.
 Varme artikler
Varme artikler
-
 Nye mål i kampen mod antibiotikaresistensProfessor Stephan A. Sieber og Dr. Sabine Schneider i laboratoriet for formanden for organisk kemi II ved det tekniske universitet i München. Kredit:Andreas Battenberg / TUM Bakterier er i stigend
Nye mål i kampen mod antibiotikaresistensProfessor Stephan A. Sieber og Dr. Sabine Schneider i laboratoriet for formanden for organisk kemi II ved det tekniske universitet i München. Kredit:Andreas Battenberg / TUM Bakterier er i stigend -
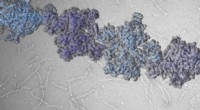 Enigma med fedtsyremetabolisme løst - enzymform styrer aktivitetenACC filamenter regulerer enzymaktivitet og kontrollerer dermed fedtsyreproduktionen. Kredit:Universitetet i Basel, Biozentrum Kernekomponenterne i alt kropsfedt er fedtsyrer. Deres produktion init
Enigma med fedtsyremetabolisme løst - enzymform styrer aktivitetenACC filamenter regulerer enzymaktivitet og kontrollerer dermed fedtsyreproduktionen. Kredit:Universitetet i Basel, Biozentrum Kernekomponenterne i alt kropsfedt er fedtsyrer. Deres produktion init -
 Nyt gennembrud inden for nanoteknologi, der bruger atmosfærisk kulstof til at fremstille nyttige ke…Fra venstre, en blanding af gasser, inklusive CO2 (rød og grå), N2 (blå), og H2 (hvid) er udsat for den nanoporøse metal-organiske ramme designet af Johnson-gruppen. Kun CO2 og H2 kommer ind i MOF, so
Nyt gennembrud inden for nanoteknologi, der bruger atmosfærisk kulstof til at fremstille nyttige ke…Fra venstre, en blanding af gasser, inklusive CO2 (rød og grå), N2 (blå), og H2 (hvid) er udsat for den nanoporøse metal-organiske ramme designet af Johnson-gruppen. Kun CO2 og H2 kommer ind i MOF, so -
 Nøglebyggesten til organiske molekyler opdaget i meteoritterEt fragment af Murchison-meteoritten, en af de tre kulstofrige meteoritter, der blev udtaget i denne undersøgelse. Kredit:Daniel P. Glavin Forskere fra Japan og USA har bekræftet tilstedeværelse
Nøglebyggesten til organiske molekyler opdaget i meteoritterEt fragment af Murchison-meteoritten, en af de tre kulstofrige meteoritter, der blev udtaget i denne undersøgelse. Kredit:Daniel P. Glavin Forskere fra Japan og USA har bekræftet tilstedeværelse
- NASAs nye asteroidalarmsystem giver fem dages advarsel
- Hvem tog på Apollo 11-mission?
- Hvordan laver man hjemmelavet kuldioxid?
- En ny syntetisk nanofabrik inspireret af naturen
- Koblede magnetiske materialer viser interessante egenskaber til kvanteanvendelser
- Sammenligning af haploid celle med en diploid celle?


