Hvilke forskere brugte atomspektre til at udvikle en model af atomet?
* Niels Bohr: I 1913 brugte Bohr de spektrale linjer af brint til at foreslå hans model af atomet, hvor elektroner kredserede kernen i specifikke energiniveauer. Han forklarede de spektrale linjer ved at oplyse, at elektroner kunne hoppe mellem energiniveauet ved at absorbere eller udsende fotoner af lys.
* Johannes Rydberg: Før Bohr observerede Rydberg mønstre i de spektrale linjer af brint og udviklede en empirisk formel til at forudsige deres bølgelængder. Denne formel, nu kendt som Rydberg -formlen, var medvirkende til Bohrs udvikling af hans model.
* Joseph John Thomson: Mens Thomsons blommepudding -model senere blev erstattet af Bohrs model, lagde hans opdagelse af elektronet og hans arbejde om katodestrålernes natur grundlaget for forståelse af atomstruktur.
* max planck: Selvom det ikke var direkte involveret i atommodeller, var Plancks arbejde med kvanteteori afgørende for at forklare eksistensen af diskrete spektrale linjer. Han foreslog, at energi er kvantiseret, hvilket betyder, at den kun kan eksistere i specifikke pakker kaldet Quanta.
Mens Bohrs model var et betydeligt gennembrud, var det ikke det sidste ord om atomstruktur. Senere udviklinger inden for kvantemekanik, især arbejdet med Erwin Schrödinger og Werner Heisenberg, førte til udviklingen af den mere nøjagtige og sofistikerede model af det atom, vi bruger i dag.
Generelt spillede studiet af atomspektre en afgørende rolle i udviklingen af vores forståelse af atomet. Det gav bevis for eksistensen af kvantiserede energiniveauer og hjalp med at forme vores forståelse af, hvordan elektroner opfører sig inden for atomet.
Sidste artikelHvorfor adskiller plasma sig fra fast væske og gas?
Næste artikelHvordan ved forskere om strukturen af et atom?
 Varme artikler
Varme artikler
-
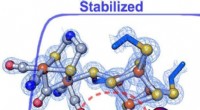 Forskere finder, hvordan enzymmiljø ændrer hastigheden og retningen af en reaktionForskere fandt ud af, at subtile ændringer i proteinstilladet omkring et enzyms katalytiske center på eksakt måde styrer hastigheden og retningen af kemiske reaktioner. Inden for [FeFe] -hydrogenase
Forskere finder, hvordan enzymmiljø ændrer hastigheden og retningen af en reaktionForskere fandt ud af, at subtile ændringer i proteinstilladet omkring et enzyms katalytiske center på eksakt måde styrer hastigheden og retningen af kemiske reaktioner. Inden for [FeFe] -hydrogenase -
 Forskere får et atomistisk billede af platinkatalysatornedbrydningRøntgendiffraktionsopsætning ved ID31-strålelinje, European Synchrotron Radiation Facility. Kredit:Natalie Stubb Nedbrydning af platin, bruges som et nøgleelektrodemateriale i brintøkonomien, fork
Forskere får et atomistisk billede af platinkatalysatornedbrydningRøntgendiffraktionsopsætning ved ID31-strålelinje, European Synchrotron Radiation Facility. Kredit:Natalie Stubb Nedbrydning af platin, bruges som et nøgleelektrodemateriale i brintøkonomien, fork -
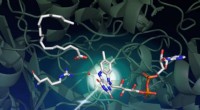 Forskere afdækker strukturen af lysdrevet enzym med potentielle anvendelser af biobrændstofEn undersøgelse med SLACs LCLS røntgenlaser fangede, hvordan lys driver en række komplekse strukturelle ændringer i et enzym kaldet FAP, som katalyserer omdannelsen af fedtsyrer til udgangsbestandde
Forskere afdækker strukturen af lysdrevet enzym med potentielle anvendelser af biobrændstofEn undersøgelse med SLACs LCLS røntgenlaser fangede, hvordan lys driver en række komplekse strukturelle ændringer i et enzym kaldet FAP, som katalyserer omdannelsen af fedtsyrer til udgangsbestandde -
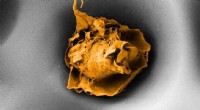 Hvorfor hviler makrofager i sundt vævEn makrofag i en pore, der måler 20 mikrometer på tværs (elektronmikroskopbillede). Kredit:ETH Zürich / Nikhil Jain og Isabel Gerber ETH -forskere har vist, at immunsystemets makrofager ikke kun r
Hvorfor hviler makrofager i sundt vævEn makrofag i en pore, der måler 20 mikrometer på tværs (elektronmikroskopbillede). Kredit:ETH Zürich / Nikhil Jain og Isabel Gerber ETH -forskere har vist, at immunsystemets makrofager ikke kun r
- Forståelse af den nordlige bevægelse af den subtropiske vestlige jet i skiftende klimaer
- Forskellen mellem skorpen og mantelen er primært på grundlag af en forskel i?
- Hvad er forskellen mellem tiltrækkende og frastødende kræfter?
- Virtuelle influencers er her, men burde Meta virkelig sætte de etiske grundregler?
- NASAs etårige mission undersøger, hvordan rummet påvirker astronauternes funktionelle ydeevne
- Producerer brint ved at bruge mindre energi


