Forskere finder, hvordan enzymmiljø ændrer hastigheden og retningen af en reaktion
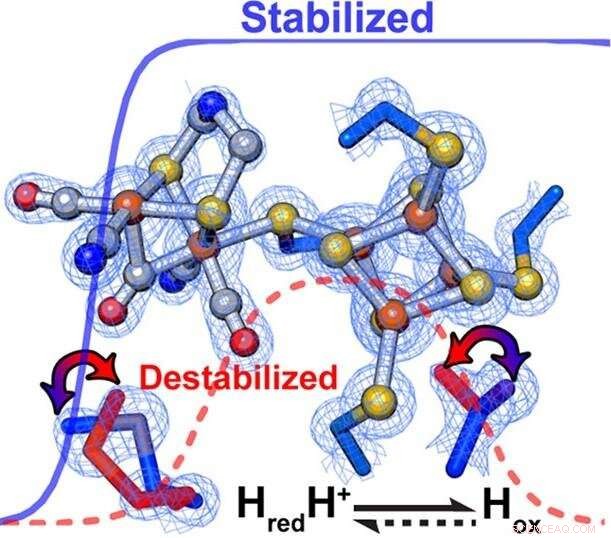
Forskere fandt ud af, at subtile ændringer i proteinstilladet omkring et enzyms katalytiske center på eksakt måde styrer hastigheden og retningen af kemiske reaktioner. Inden for [FeFe] -hydrogenaser, sekundære interaktioner påvirkede direkte den relative stabilisering/destabilisering af forskellige oxidationstilstande i den aktive metalklynge. Kredit:PNNL
Mens forskere leder efter måder at udvikle og forbedre dagligdags produkter lige fra brændstof til medicin, enzymer giver naturens eksempel på den kontrol, der er nødvendig for at få kemiske reaktioner til at fungere på ønskede måder. Men et fænomen kendt som katalytisk bias fortsætter med at stubbe forskere.
Proteinstilladset omkring et enzyms katalytiske kerne styrer udsøgt reaktivitet, herunder retning og hastighed for kemiske processer. Forskere omtaler denne finjustering som "katalytisk bias" - og hvordan det sker, er stadig meget diskuteret.
Mysteriet er et skridt tættere på at blive løst.
Et forskerhold fra tre nationale laboratorier i det amerikanske energiministerium (DOE) og fire universiteter fandt ud af, at subtile ændringer i miljøet omkring nogle enzymer ikke kun kan ændre hastigheden af en cellulær reaktion med svimlende seks størrelsesordener, men også dens retning. Denne vending-roden til det katalytiske bias-dilemma-er som at køre i en retning med 10 miles i sekundet, derefter gå i den modsatte retning ved 1, 000, 000 miles i sekundet. Kløften tilføjer hurtigt.
"Afhængigt af det ønskede resultat, bias kan være uoverstigelig eller en af de bedste ting, der nogensinde er sket, "sagde Simone Raugei, en beregningsforsker ved PNNL og medforfatter på undersøgelsen. "En reaktion kan have mange mellemprodukter og kan tage flere veje - nogle mere effektive end andre. Så at kunne indstille katalysatormiljøet kan gøre en bemærkelsesværdig forskel i reaktionshastigheden."
Fundene, rapporteret i Journal of the American Chemical Society , have betydelige konsekvenser for design af syntetiske katalysatorer, der anvendes i industrielle omgivelser hvor forudsigelse og kontrol af reaktionens adfærd er kritisk. Resultaterne giver også en større grundlæggende forståelse af de faktorer, der styrer metaboliske processer i alt liv.
Katalytisk bias i metalloenzymer
I naturen, mikroben Clostridium pasteurianum (Cp) producerer flere jernbaserede enzymer, [FeFe] -hydrogenaser, der er blandt en stor gruppe af metalloenzymer. Metalloenzymer er involveret i en lang række reaktioner, der tjener mange funktioner, såsom at flytte brint gennem mikrobielle samfund, fange nitrogen fra luften, fremstilling af metan, og omdannelse af kulhydrater.
Alsidigheden gør metalloenzymerne, og [FeFe] -hydrogenaser specifikt, ideelle emner til at udforske grundlæggende spørgsmål i forbindelse med kemiske transformationer. Faktisk, hydrogenaser har været inspirationskilden til talrige undersøgelser af elektrokatalyse i energiomdannelsesreaktioner finansieret gennem DOE's Office of Basic Energy Sciences, sagde Morris Bullock, direktør for Center for Molekylær Elektrokatalyse, et DOE Energy Frontier Research Center.
"Opdagelser rapporteret af forskellige forskningsgrupper ved hjælp af komplementære tilgange beriger vores forståelse af det grundlæggende videnskabelige grundlag for katalyse af både biologiske og molekylære systemer, "sagde Bullock.
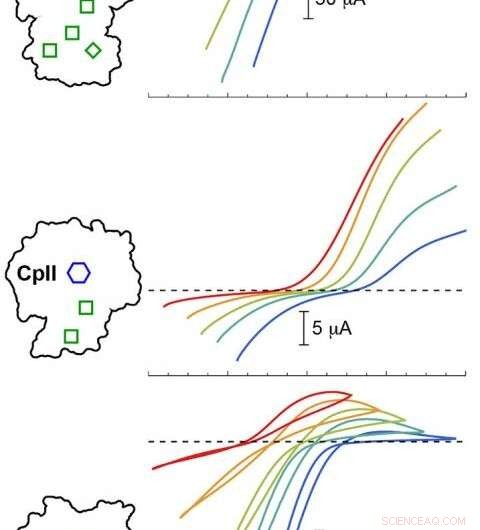
PNNL -beregningsmodellering validerede eksperimenter med tre Cp -hydrogenaser ved forskellige pH -værdier. Resultaterne viste, at katalytisk potentiale (farvede kurver) varierede afhængigt af arrangementet af H-klyngen (blå sekskant) og tilbehørsklynger (grønne kasser). Farvede spor under den stiplede linje svarer til brintproduktion, mens spor over den stiplede linje svarer til hydrogenoxidation. Kredit: J. Am. Chem. Soc . 2020, 142, 3, 1227-1235
PNNL-ansat John Peters er professor ved Washington State University (WSU) og direktør for Biologisk og elektronoverførsel og katalyse, et andet DOE Energy Frontier Research Center. Peters begyndte først at studere [FeFe] -hydrogenaser i slutningen af 1990'erne ved hjælp af enzymer fundet i Cp-mikroben. Men de tidligere undersøgelser fokuserede på generelle mekanistiske aspekter, og først for nylig er forskere begyndt at tænke på enzymer i forbindelse med katalytisk bias.
Peters og Paul King, leder af gruppen for fysisk biokemi og fotosyntese ved National Renewable Energy Laboratory (NREL), co-designet det nye studie med Raugei på PNNL og Anne Jones, en lektor på School of Molecular Sciences ved Arizona State University (ASU).
Undersøgelsen havde til formål at identificere, hvordan tre [FeFe] -hydrogenaser adskiller sig i at kontrollere både protonreduktion til molekylært hydrogen, samt omvendt reaktion - oxidation af molekylært brint til protoner. Hver såkaldt redoxreaktion spiller en kritisk rolle i biologisk energioverførsel og er blevet grundigt undersøgt for energilagring og produktionsapplikationer.
Elektrostatik finjusterer reaktionsmellemprodukter
Undersøgelsen af katalytisk aktivitet af de tre [FeFe] hydrogenaser involverede en kraftfuld kombination af eksperimentelle tilgange på talrige forskningsfaciliteter og udført af forskere fra WSU, NREL og ASU. Raugei, også en fælles udpeget hos WSU, ledet det teoretiske og beregningsmæssige modelleringsteam, hvis opgave var at sortere de eksperimentelle observationer og udvikle en teoretisk model for den enzymatiske mekanisme.
Forskerteamet brugte præcise målinger fra røntgenstråler på Linac Coherent Light Source-anlægget, placeret ved Stanford Synchrotron Radiation Lightsource, at analysere enzymets atomstruktur. Næste, forskere ved ASU udsatte enzymet for en elektrisk strøm for at undersøge den elektrokatalytiske aktivitet af hver hydrogenase i både hvilende og aktive tilstande. Alle enzymerne delte en identisk katalytisk klynge af jern- og svovlatomer-generelt kaldet H-klyngen-men var forskellige i sammensætningen af det omgivende proteinmiljø.
Forskerne bemærkede betydelige forskelle i reaktionsforskydningen mellem de tre hydrogenaser. Derefter, under feedback -sløjfer mellem eksperimenterne og beregningsmodeller, subtile ændringer i det elektrostatiske felt omkring det katalytiske center fangede holdets opmærksomhed.
"Vi så faktisk, at hvis feltet blev ændret, vi var i stand til at drive reaktionen mere positivt på en eller anden måde for at forsøge at forklare den eksperimentelle observation, "sagde Raugei. De subtile forskelle i miljøet, han sagde, bestemte reaktionsretningen under steady state-forhold og finjusterede reaktionshastigheden.
Ifølge King, den selektive stabilisering eller destabilisering af katalytiske mellemprodukter fremmer fortrinsvis hydrogenoxidation eller protonreduktion. Specifikt, et mere hydrofobt miljø omkring H-klyngen afstemte enzymet til fortrinsvis at favorisere brintproduktion, der henviser til, at hydrogenoxidation blev begunstiget af et mindre hydrofobt miljø.
"Dette arbejde, "sagde kongen, "afslører biologiens magt til at kontrollere metalloenzymernes reaktivitet for at møde de unikke metaboliske processer i alt liv og giver værdifuld ny indsigt i designet af forbedrede elektrokatalytiske platforme."
Peters sagde, at de designfunktioner, som [FeFe] -hydrogenaser bruger til at justere og kontrollere reaktivitet, sandsynligvis deles mellem andre metal-site biokatalysatorer. Forskerne planlægger at forfine deres model for at give en mere generel plan for at forstå katalytisk bias i den større klasse af redoxenzymer - og den metaboliske energi, der driver alt liv.
 Varme artikler
Varme artikler
-
 Livet af et skumTre eksperimenter om bord på Maxus 6-sonderaketten vil undersøge skumets egenskaber. Maxus 6-sonende raket er planlagt til opsendelse fra Esrange, Swedish Space Corporation raketbase nær Kiruna, i det
Livet af et skumTre eksperimenter om bord på Maxus 6-sonderaketten vil undersøge skumets egenskaber. Maxus 6-sonende raket er planlagt til opsendelse fra Esrange, Swedish Space Corporation raketbase nær Kiruna, i det -
 Foldet papir skaber et bærbart laboratorium til feltlaboratorietestsOvervågning og sporing af biologiske trusler eller epidemier kræver evnen til at udføre test i marken under barske situationer. Dyrt laboratorieudstyr er ofte ikke tilgængeligt i disse indstillinger,
Foldet papir skaber et bærbart laboratorium til feltlaboratorietestsOvervågning og sporing af biologiske trusler eller epidemier kræver evnen til at udføre test i marken under barske situationer. Dyrt laboratorieudstyr er ofte ikke tilgængeligt i disse indstillinger, -
 Mikroskala termoforese til at karakterisere hits fra high-throughput screeningMikroskala termoforese til at karakterisere hits fra high-throughput screening:et europæisk blyfabriksperspektiv. Kredit:European Lead Factory En ny perspektivartikel i marts 2018-udgaven af SLAS
Mikroskala termoforese til at karakterisere hits fra high-throughput screeningMikroskala termoforese til at karakterisere hits fra high-throughput screening:et europæisk blyfabriksperspektiv. Kredit:European Lead Factory En ny perspektivartikel i marts 2018-udgaven af SLAS -
 Scanning af overfladen af lithiumtitanatDen tredobbelte symmetri, der er angivet her, afslører spinelkrystalstrukturen. Kredit:Taro Hitosugi, Naturkommunikation Forskere ved Tokyo Institute of Technology, Tohoku University og Universi
Scanning af overfladen af lithiumtitanatDen tredobbelte symmetri, der er angivet her, afslører spinelkrystalstrukturen. Kredit:Taro Hitosugi, Naturkommunikation Forskere ved Tokyo Institute of Technology, Tohoku University og Universi
- Sådan tolk lineære ligninger
- Forskere undersøger måder, hvorpå et lægemiddel som Avandia kan gøres mere sikkert
- Millioner af bytræer er i fare for stigende temperaturer
- Populistiske euroskeptikere vinder ikke ved terrorangreb
- Første størrelsesbaserede kromatografiteknik til undersøgelse af levende celler
- Mark Zuckerberg:Facebook har stoppet Rusland og Iran kampagner for at blande sig i valget i 2020


