Første størrelsesbaserede kromatografiteknik til undersøgelse af levende celler
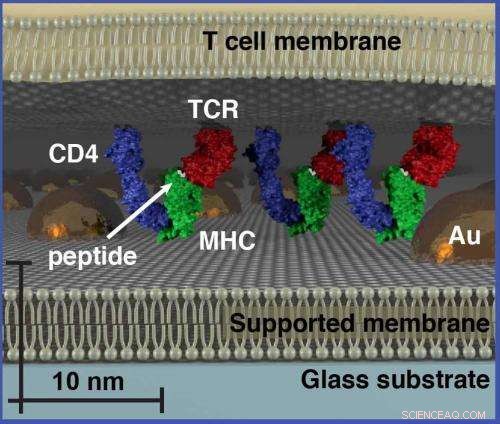
Med størrelsesbaseret kromatografi, en sekskantet ordnet række guld-nanopartikler fremstilles på en hybrid levende cellestøttet membran. Membrankomponenter bevæger sig frit gennem arrayet, forudsat at de ikke overstiger dets fysiske dimensioner. Dette afslører organisatoriske aspekter af membranmiljøet, der ikke kan observeres ved andre teknikker.
(Phys.org) - Ved hjælp af nanodot -teknologi, Berkeley Lab-forskere har demonstreret den første størrelsesbaserede form for kromatografi, der kan bruges til at studere membraner i levende celler. Denne unikke fysiske tilgang til sonderende cellemembranstrukturer kan afsløre information kritisk for, om en celle lever eller dør, forbliver normal eller bliver kræft, der ikke kan opnås ved konventionel mikroskopi.
"Vi har udviklet membranindlejrede nanodot-array-platforme, der giver et fysisk middel til både at undersøge og manipulere membransamlinger, herunder signalklynger, mens de fungerer i membranen af en levende celle, "siger Jay Groves, en kemiker med Berkeley Labs division for fysiske biovidenskaber, der ledede denne forskning.
Lunde, som også er professor ved University of California (UC) Berkeleys kemiafdeling, og en Howard Hughes Medical Institute (HHMI) efterforsker, er en anerkendt leder inden for udvikling af teknikker til undersøgelse af rummønstres indvirkning på levende celler. De levende cellestøttede syntetiske membraner, han og hans gruppe har udviklet, er konstrueret af lipider og samlet på et substrat af fast silica. Disse membraner bruges til at bestemme, hvordan levende celler ikke kun interagerer med deres miljø gennem kemiske signaler, men også gennem fysisk kraft og rumlige mønstre.
"Vi kalder vores tilgang for den rumlige mutationsstrategi, fordi molekyler i en celle kan rumligt omarrangeres uden at ændre cellen på anden måde, "Groves siger." Vores levende cellestøttede membraner giver en hybrid-grænseflade bestående af mobile og immobile komponenter med kontrolleret geometri, der giver os mulighed for at udnytte solid-state nanoteknologi til at manipulere og kontrollere molekylære systemer inde i levende celler. "

Jay Groves. Kredit:Roy Kaltschmidt
Selvom Groves og andres arbejde i de senere år har vist vigtigheden af protein og lipid rumlig organisering inden for cellulære membraner, Detaljer om, hvordan rumlig organisation er knyttet til funktion, er primært knappe på grund af begrænsningerne ved optisk mikroskopi på længdeskalaer under 250 nanometer diffraktionsgrænsen. Den størrelsesbaserede kromatografiteknik, der er udviklet af Groves og hans gruppe, gør det muligt for dem at undersøge supramolekylære strukturer i en cellemembran ved de nødvendige nanometerlængder.
"Vi har nu en måde at oversætte strukturer i nanostørrelse, der nærmer sig molekylære dimensioner, til geometriske begrænsninger for bevægelse af molekyler inde i en levende celle, "Siger Groves.
For deres størrelsesbaserede kromatografiteknik, afstanden mellem proteiner og andre cellulære molekyler styres af en sekskantet eller honningkage række guld -nanopartikler, der er fremstillet i membranen. Afstanden mellem nanopartikler i hvert array kan kontrolleres, med tilgængelige størrelser fra 30 til næsten 200 nanometer.
"Individuelle membrankomponenter bevæger sig frit i hele arrayet, men bevægelse af større samlinger hæmmes, hvis de overskrider matrixens fysiske dimensioner, Groves siger.
Groves og hans kolleger testede deres størrelsesbaserede kromatografiteknik på T-celle receptor (TCR) mikroklynger i T-cellemembraner, som er det funktionelle modul til antigengenkendelse af T -celler (lymfocytter fra thymus) i kroppens immunsystem. Disse TCR -signalklynger indtager et størrelsesregime, der spænder fra tiere til et par hundrede nanometer, som typisk er under diffraktionsgrænsen for konventionel optisk mikroskopi. Størrelsesbaseret kromatografi blev brugt til at undersøge de fysiske egenskaber ved TCR-signalklynger som en funktion af antigens tæthed. Resultaterne afslørede, at TCR -signaleringsklynge er klart afhængig af mængden af antigen, som cellen støder på.
"Dette er noget, vi ikke vidste før om TCR -mikroclustersignalsystemet, som er blevet undersøgt godt ved hjælp af konventionel optisk mikroskopi, "Groves siger." Det er en bevis-på-princip-demonstration, der repræsenterer endnu et skridt i retning af grænseflade mellem levende celler og syntetiske materialer for at opnå molekylær kontrol af cellen. "
Sidste artikelEn ny tilgang til konstruktion af fremtidens materialer
Næste artikelIndhyllede DNA -nanodeapparater overlever pilotmission
 Varme artikler
Varme artikler
-
 Brug af scotch tape og laserstråler, forskere laver nyt materiale, der kan forbedre LED-skærmeKredit:University of Kansas En forsidehistorie, der vises i det peer-reviewede tidsskrift Nanoskala horisonter rapporterer et nyt dobbeltlagsmateriale, med hvert lag, der måler mindre end én nan
Brug af scotch tape og laserstråler, forskere laver nyt materiale, der kan forbedre LED-skærmeKredit:University of Kansas En forsidehistorie, der vises i det peer-reviewede tidsskrift Nanoskala horisonter rapporterer et nyt dobbeltlagsmateriale, med hvert lag, der måler mindre end én nan -
 Bioinspirerede elektromekaniske nanogeneratorer til at regulere celleaktivitetSkematiske illustrationer af elektromekaniske koblingsbio-NGer, der modulerer celleaktivitet inspireret af ECM. (A) Kollagenfibrene i ECM omdanner cellens iboende kraft til bioelektricitet, som også u
Bioinspirerede elektromekaniske nanogeneratorer til at regulere celleaktivitetSkematiske illustrationer af elektromekaniske koblingsbio-NGer, der modulerer celleaktivitet inspireret af ECM. (A) Kollagenfibrene i ECM omdanner cellens iboende kraft til bioelektricitet, som også u -
 Guldpartikler i nanostørrelse er blevet formet til at opføre sig som kloner i biomedicinUltramonodisperse guld nanorods, der opfører sig som kloner fra et optisk synspunkt. Kredit:Guillermo González Rubio. At forme nanometriske guldpartikler - på størrelse med milliontedele af en mil
Guldpartikler i nanostørrelse er blevet formet til at opføre sig som kloner i biomedicinUltramonodisperse guld nanorods, der opfører sig som kloner fra et optisk synspunkt. Kredit:Guillermo González Rubio. At forme nanometriske guldpartikler - på størrelse med milliontedele af en mil -
 En skabelon til hurtig syntese af nanografenerAPEX-reaktioner udføres på K, M- og bugtområder af det polycykliske aromatiske carbonhydrid, syntetisere flere nanografener. Disse reaktioner kan derefter gentages, yderligere at øge antallet af poten
En skabelon til hurtig syntese af nanografenerAPEX-reaktioner udføres på K, M- og bugtområder af det polycykliske aromatiske carbonhydrid, syntetisere flere nanografener. Disse reaktioner kan derefter gentages, yderligere at øge antallet af poten
- Lysosom: Definition, struktur og funktion
- Producerer grafen fra kuldioxid
- Siemens planlægger at lancere Healthineers i første halvdel af 2018
- Matematikere finder kernemekanismen til at beregne tipping points
- Enzym har vist sig at kontrollere dannelsen af kollagenbærere og hæmme kollagensekretion
- Klimafjendtlighed, kulstof, kan blive en værdifuld ressource


