Hvad gennemgår opvarmet vand og bliver damp?
* varmeenergi: Når du opvarmer vand, tilføjer du energi til dets molekyler.
* Øget molekylær bevægelse: Denne tilsatte energi får vandmolekylerne til at bevæge sig hurtigere og vibrere mere kraftigt.
* Breaking Bonds: Når molekylerne bevæger sig hurtigere, kolliderer de oftere og med større kraft. Dette kan overvinde kræfterne, der holder dem sammen i flydende tilstand.
* faseændring: Nogle molekyler undslipper den flydende overflade og går ind i luften som individuelle vanddampmolekyler.
* damp: Vandet i luften, nu i en gasformig tilstand, kaldes vanddamp.
Nøglepunkter:
* kogepunkt: Når vand når sit kogepunkt (100 ° C eller 212 ° F), sker fordampning meget hurtigere. Dette skyldes, at molekylerne har nok energi til at bryde fri fra den flydende overflade endnu lettere.
* fordampning vs. kogning: Fordampning kan ske ved enhver temperatur, selv under kogepunktet. Det er bare en langsommere proces. Kogning er en hurtigere form for fordampning, der sker ved en bestemt temperatur.
Fortæl mig, hvis du gerne vil vide mere om de forskellige tilstande af stof eller fordampningsprocessen!
Sidste artikelEr fremstillingen af isterninger en eksoterm reaktion?
Næste artikelHvilken type materiale er luft?
 Varme artikler
Varme artikler
-
 Angriber RNA med småmolekylære lægemidlerRNA -synthesizeren, der bruges til at forberede korte, fluorescensmærkede RNA-substrater til det nye studie. Kredit:Olga Fedorova/Yale University Yale-forskere har udviklet en måde at målrette RNA
Angriber RNA med småmolekylære lægemidlerRNA -synthesizeren, der bruges til at forberede korte, fluorescensmærkede RNA-substrater til det nye studie. Kredit:Olga Fedorova/Yale University Yale-forskere har udviklet en måde at målrette RNA -
 Ny metode til at løse plastiks bæredygtighedsproblemDr. Junpeng Wang. Kredit:University of Akron Bæredygtighed i plast er kommet langt i de seneste år, i høj grad takket være videnskabelige fremskridt. Men selvom plast bliver mere og mere miljøvenl
Ny metode til at løse plastiks bæredygtighedsproblemDr. Junpeng Wang. Kredit:University of Akron Bæredygtighed i plast er kommet langt i de seneste år, i høj grad takket være videnskabelige fremskridt. Men selvom plast bliver mere og mere miljøvenl -
 Fremstilling af lettere køretøjer med magnesiumlegeringerBarber kun 100 kg af en bils vægt, og du vil øge dens energieffektivitet med omkring 3,5 %. Kredit:iStock EPFL-forskere har udviklet modeller af magnesiumlegeringer for at forstå, hvordan man gør
Fremstilling af lettere køretøjer med magnesiumlegeringerBarber kun 100 kg af en bils vægt, og du vil øge dens energieffektivitet med omkring 3,5 %. Kredit:iStock EPFL-forskere har udviklet modeller af magnesiumlegeringer for at forstå, hvordan man gør -
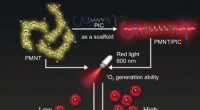 Biomimetisk hydrogel med fotodynamisk antimikrobiel effektKredit:Wiley Infektioner er en frygtet trussel, der kan få fatale konsekvenser efter en operation, ved behandling af sår, og under vævsteknologi. Biomimetiske hydrogeler med indbyggede antimikrobi
Biomimetisk hydrogel med fotodynamisk antimikrobiel effektKredit:Wiley Infektioner er en frygtet trussel, der kan få fatale konsekvenser efter en operation, ved behandling af sår, og under vævsteknologi. Biomimetiske hydrogeler med indbyggede antimikrobi
- Kan loven om bevaringselektricitet, der skal bruges i energiændringer, et system?
- Et frastødende materiale:Nye hydrogelegenskaber domineret af elektrostatisk frastødning
- Genetiske spor til, hvordan hunde blev menneskets bedste venner
- Når det første valg ikke er tilgængeligt, hvorfor vælger forbrugerne så ikke oplagt andet valg?…
- Hvad er en madørken?
- Hvilket atmosfærelag strækker sig fra 80 km over jordens overflade og ud i rummet?


