Hvad sker der, når kobbersulfat opløses i vand?
1. Dissociation: Den ioniske sammensatte kobbersulfat bryder fra hinanden i dets bestanddele:
* cu 2+ (Kobber (II) ioner) - Disse er ansvarlige for den blå farve på løsningen.
* så 4 2- (Sulfationer) - Disse er farveløse.
2. Hydrering: Ionerne bliver omgivet af vandmolekyler. De delvist negative iltatomer af vandmolekyler tiltrækkes af de positivt ladede kobberioner, og de delvist positive brintatomer af vandmolekyler tiltrækkes af de negativt ladede sulfationer. Denne proces kaldes hydrering.
3. Dannelse af en vandig opløsning: De hydratiserede ioner er spredt i hele vandet og danner en homogen opløsning.
samlet reaktion:
Cuso 4 (S) + H 2 O (l) → [cu (h 2 O) n ] 2+ (aq) + [så 4 (H 2 O) m ] 2- (aq)
Hvor 'n' og 'm' repræsenterer antallet af vandmolekyler, der hydrerer henholdsvis kobber- og sulfationer.
Nøgleobservationer:
* Opløsningen bliver blå på grund af tilstedeværelsen af hydratiserede kobber (II) -ioner.
* Opløsningen bliver lidt sur, da sulfationerne reagerer med vand i lille grad og frigiver hydrogenioner (H+).
Bemærk: Opløsningsprocessen er eksoterm, hvilket betyder, at varme frigøres, og opløsningen bliver lidt varmere.
Sidste artikelHvad er de tre vigtigste subatomære partikler i et atom?
Næste artikelHvordan ledning i Thermos fungerer?
 Varme artikler
Varme artikler
-
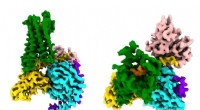 CryoEM-undersøgelse fanger opioid-signalering i handlingForskere ser for første gang, hvordan et syntetisk opioidlægemiddel (orange) binder sig til µ-opioidreceptorerne (grønne) i hjernen, og aktivere signalmolekyler i neuroner (G⍺s i guld, Gβ i cyan, Gγ i
CryoEM-undersøgelse fanger opioid-signalering i handlingForskere ser for første gang, hvordan et syntetisk opioidlægemiddel (orange) binder sig til µ-opioidreceptorerne (grønne) i hjernen, og aktivere signalmolekyler i neuroner (G⍺s i guld, Gβ i cyan, Gγ i -
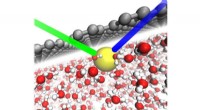 Den subtile rolle af overflader i ion-klæbrighedI vand (røde og hvide strukturer), den direkte interaktion mellem grafen (grå) og en thiocyanat (SCN‒) ion (gul) får ionen til at adsorbere til overfladen. De grønne og blå linjer repræsenterer indfal
Den subtile rolle af overflader i ion-klæbrighedI vand (røde og hvide strukturer), den direkte interaktion mellem grafen (grå) og en thiocyanat (SCN‒) ion (gul) får ionen til at adsorbere til overfladen. De grønne og blå linjer repræsenterer indfal -
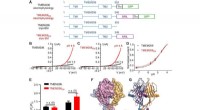 Kryo-elektronmikroskopisk struktur af en protonaktiveret kloridkanal ved navn TMEM206Funktion og struktur af pufferfish TMEM206. (A) Skematisk af kanalkonstruktioner, der anvendes til elektrofysiologi og enkeltpartikel-kryo-EM-eksperimenter. Thr repræsenterer et thrombin-spaltningsste
Kryo-elektronmikroskopisk struktur af en protonaktiveret kloridkanal ved navn TMEM206Funktion og struktur af pufferfish TMEM206. (A) Skematisk af kanalkonstruktioner, der anvendes til elektrofysiologi og enkeltpartikel-kryo-EM-eksperimenter. Thr repræsenterer et thrombin-spaltningsste -
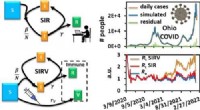 Kemi-laboratoriestuderende forudsiger spredning af COVID-19 med kinetikmodellerI denne graf forudsagde studerende i forårets kinetiklaboratorium daglige tilfælde i staten Ohio til efteråret 2022. Kredit:Ohio University Kemiker Jixin Chen så på den hurtige spredning af COVID-1
Kemi-laboratoriestuderende forudsiger spredning af COVID-19 med kinetikmodellerI denne graf forudsagde studerende i forårets kinetiklaboratorium daglige tilfælde i staten Ohio til efteråret 2022. Kredit:Ohio University Kemiker Jixin Chen så på den hurtige spredning af COVID-1


