Hvorfor kan gasser klemmes, men faste stoffer kan ikke?
Gasser:
* afstand: Gasmolekyler er meget langt fra hinanden med masser af tomme rum mellem dem.
* Bevægelse: Gasmolekyler bevæger sig tilfældigt og ved høje hastigheder.
* svage interaktioner: Kræfterne til tiltrækning mellem gasmolekyler er meget svage.
hvordan komprimering fungerer:
* Når du lægger pres på en gas, tvinger du molekylerne tættere sammen, hvilket reducerer det tomme rum.
* Molekylerne bevæger sig stadig tilfældigt, men de kolliderer oftere og øger trykket.
faste stoffer:
* tæt pakket: Faste molekyler er tæt pakket sammen med meget lidt tom plads.
* faste positioner: Molekyler i en fast vibration i faste positioner. De bevæger sig ikke frit som gasmolekyler.
* Stærke interaktioner: Kræfterne til tiltrækning mellem faste molekyler er meget stærkere end i gasser.
Hvorfor komprimering er vanskelig:
* De stærke kræfter, der holder molekylerne sammen i et solidt, modstår ethvert forsøg på at skubbe dem nærmere.
* Da molekylerne allerede er tæt pakket, er der meget lidt plads til at komprimere dem yderligere.
Nøgleforskelle:
* afstand: Gasser har masser af plads, faste stoffer har meget lidt.
* Bevægelse: Gasmolekyler bevæger sig frit, faste molekyler vibrerer på plads.
* kræfter: Gasmolekyler har svage attraktioner, faste molekyler har stærke attraktioner.
Vigtig note: Mens faste stoffer ikke kan komprimeres på samme måde som gasser, kan de stadig deformeres (formes forskelligt) under tryk. Dette skyldes, at molekylerne inden for et fast stof kan justere deres positioner lidt.
 Varme artikler
Varme artikler
-
 Verdens første opdagelse kan give næring til den nye grønne ammoniakøkonomiKredit:CC0 Public Domain I en verdensnyhed, Monash University-forskere har udviklet en ny, miljøvenlig proces, der kan drive den fremtidige produktion af grøn ammoniak. Ammoniak (NH 3 ) er en g
Verdens første opdagelse kan give næring til den nye grønne ammoniakøkonomiKredit:CC0 Public Domain I en verdensnyhed, Monash University-forskere har udviklet en ny, miljøvenlig proces, der kan drive den fremtidige produktion af grøn ammoniak. Ammoniak (NH 3 ) er en g -
 Ny familie af glas god til linserYe Luo (til højre), doktorand i materialevidenskab og teknik, hælder ny sammensætning af germanosilikatglas i form. Kredit:Penn State En ny sammensætning af germanosilikatglas skabt ved tilsætning
Ny familie af glas god til linserYe Luo (til højre), doktorand i materialevidenskab og teknik, hælder ny sammensætning af germanosilikatglas i form. Kredit:Penn State En ny sammensætning af germanosilikatglas skabt ved tilsætning -
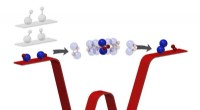 Med ultrakold kemi, forskere får et første kig på præcis, hvad der sker under en kemisk reaktionKemiske reaktioner omdanner reaktanter til produkter gennem en mellemliggende tilstand, hvor bindinger brydes og dannes. Ofte for kortvarig til at observere, denne fase har hidtil undgået intim unders
Med ultrakold kemi, forskere får et første kig på præcis, hvad der sker under en kemisk reaktionKemiske reaktioner omdanner reaktanter til produkter gennem en mellemliggende tilstand, hvor bindinger brydes og dannes. Ofte for kortvarig til at observere, denne fase har hidtil undgået intim unders -
 Forbedring af limningen af plast i højpræcisions mikrofluidchipsMikrofluidchips gør det muligt at analysere en dråbe blod næsten øjeblikkeligt og har potentialet til at revolutionere sundhedsvæsenet. Kredit:A*STAR Singapore Institute of Manufacturing Technology
Forbedring af limningen af plast i højpræcisions mikrofluidchipsMikrofluidchips gør det muligt at analysere en dråbe blod næsten øjeblikkeligt og har potentialet til at revolutionere sundhedsvæsenet. Kredit:A*STAR Singapore Institute of Manufacturing Technology
- Dybhavsopdagere finder sunket krigsskib fra et vigtigt WWII-slag
- Hvad er 5 eksempler på videnskabelig teori?
- Hvor længe skal du vente på, at en stjerne gennemgår sin maksimale parallaxfortrængning?
- Hvad h og n kan friktion producere?
- Hvad er den kemiske sammensætning af gipsvæg?
- Opdag, hvad der får durian til at stinke


